![]()
|
« Era come un globo dalle mille facce; splendeva come argento alla luce del fuoco, come acqua al sole, come neve sotto le stelle e come la pioggia sopra la luna. » (Lo Hobbit, cap. XII) |
Nella lezione precedente abbiamo visto come, partendo dallo spettacolo pirotecnico organizzato da Gandalf per il 111° compleanno di Bilbo, sia possibile spiegare nei dettagli la struttura dell'atomo d'idrogeno alla luce delle conoscenze della Fisica Moderna. Ma l'idrogeno è solo il primo degli elementi noti della cosiddetta Tavola Periodica, ideata nel 1869 dal chimico russo Dmitrij Ivanovič Mendeleev (1834–1907), che a tutt'oggi di elementi (tra naturali ed artificiali) ne conta ben 118. Come spiegare l'esistenza degli altri 117 elementi, senza i quali non sarebbe possibile mettere in piedi alcuna chimica ed alcuna metallurgia?
Contrariamente a quanto si potrebbe pensare di primo acchito, la chimica e la metallurgia della Terra di Mezzo erano piuttosto avanzate, e ciò soprattutto grazie ai Nani. Essi infatti furono creati di nascosto dal Vala Aulë, desideroso di insegnare a delle creature la sua arte di fabbro, e in seguito approvati da Eru, che ne fece la Terza Stirpe, dopo gli Elfi e gli Uomini. Furono loro a insegnare agli Elfi a costruire armi e armature, e in questo rimasero sempre imbattibili. Già nella mitologia norrena infatti i Nani erano considerati abili fabbri e forgiatori, come testimonia l'"Edda in prosa" di Snorri Sturluson, e così Tolkien descrive il regno di Durin I sotto la montagna:
« Era re su si un trono intarsiato
fra saloni dal gran colonnato; [...]
Ivi colpiva l'incudine il martello,
ivi l'incisor scriveva, ed oprava lo scalpello;
ivi forgiata la lame ed all'elsa unita,
ivi minator scavava e murator costruiva con fatica.
Ivi gemme perle ed opale iridescente,
e metallo lavorato come maglie di rete incandescente.
Ivi scudi e corazze, asce, spade e pugnali,
e le trombe squillavano ai cancelli. »
(SdA, libro II, cap. IV)
Per avere un'idea di cosa i Nani forgiassero nelle loro fucine, basta leggere questo passo de "Lo Hobbit", in cui Thorin e compagnia sognano i tesori ammassati nel cuore della Montagna Solitaria e guardati a vista dal drago Smaug:
«
Da ciò la conversazione passò allo sterminato mucchio di ricchezze, e alle
cose che Thorin e Balin ricordavano. In particolare si chiedevano se si
trovassero ancora lì le lance che erano state fatte per gli eserciti del gran
Re Bladorthin, avevano ciascuna una punta triplicemente forgiata e la loro asta
era mirabilmente intarsiata d'oro; la grande coppa aurea di Thror, con due
manici, cesellata e intagliata con uccelli e fiori i cui occhi e petali erano
fatti di pietre preziose; cotte di maglia dorate, argentate e impenetrabili; la
collana di Girion, signore di Dale, fatta di cinquecento smeraldi verdi come
l'erba, che egli dette ai nani perchè fosse incastonata nell'armatura del
figlio maggiore, una cotta di anelli saldati dai nani fatta di argento puro
lavorato fino a divenire tre volte più potente e robusto dell'acciaio. Ma più
bella di tutto era la grande gemma bianca che i nani avevano trovato sotto le
radici della montagna, l'Archepietra di Thrain. »
(Lo Hobbit, cap. XII)
Nel Legendarium di Tolkien sono citate parecchie sostanze chimiche e metalli vari. Ad esempio in lingua Quenya "erma" ed "orma" significano genericamente "materia", "ondo" vuol dire "pietra", "tinco" sta per "metallo", "telpë" o "tyelpe" per "argento", "anga" vuol dire "ferro", "cemen" sta per "terra", "suolo", "nén" sta per "acqua", "helcë" vuol dire "ghiaccio", "lossë" vale "neve", "litse" sta per "sabbia", "asto" per "polvere", "hyellë" per "vetro", mentre in Sindarin "gond" sta per "pietra", "malt" per "oro", "celeb" per "argento", "ang" e "angren" per "ferro", "heledh" sta per , e potremmo continuare con una lunga lista di termini, che però finirebbe per annoiarvi. Più avanti parleremo ancora di alcuni particolari metalli citati da Tolkien nelle sue opere; ora invece vogliamo vedere come è organizzata la struttura della materia indicata con questi termini.
Il primo tentativo di raggruppare gli elementi che venivano scoperti in numero via via crescente nell'ottocento, cercando regolarità nelle loro proprietà chimiche, furono portati avanti dal tedesco Johann Wolfgang Döbereiner (1780-1849), che raggruppò a tre a tre gli elementi con caratteristiche simili, ma come già si è detto la prima vera e propria tavola periodica degli elementi fu ideata da Mendeleev, che mise in fila gli elementi in ordine di massa atomica crescente, andando a capo ogni volta che si ripresentavano proprietà chimiche simili. Il risultato, stilato dallo stesso Mendeleev, è quello che si vede qui sotto, disegnato come se si trattasse di un documento stilato dai Nani:

Mendeleev si accorse che nella sua tabella rimanevano degli spazi vuoti, ed ebbe un colpo di genio: i posti ancora liberi erano destinati ad essere occupati da elementi chimici che non erano ancora stati scoperti! Come si è visto a proposito della formula di Balmer, in chimica e fisica le idee migliori sono quelle che permettono di prevedere ciò che non è ancora osservato, ma che sarà poi confermato dall'esperienza; in tal senso, la Tavola Periodica di Mendeleev rappresenta uno dei massimi successi della scienza ottocentesca! Ad esempio, nella tabella che vedete riportata qui sopra, la decima riga è incompleta, poiché fra carbonio e silicio nelle prime due colonne e lo stagno nella quarta vi è uno spazio bianco che dovrebbe corrispondere ad un elemento con massa atomica intermedia fra quelle dello zinco e dell'arsenico, e con le stesse proprietà chimiche del silicio. Mendeleev previde così l'esistenza di un elemento ancora non scoperto, che egli chiamò ekasilicio dalla radice sanscrita "eka" che significa "uno". Tale elemento venne in seguito effettivamente scoperto nel 1886 dal tedesco Clemens Alexander Winkler (1838-1904), che lo estrasse dal minerale chiamato argirodite e lo battezzò germanio, in onore della sua patria. Analogamente Mendeleev previde altri elementi, come l'ekaboro e l'ekaalluminio; il primo fu isolato nel 1879 dallo svedese Lars Fredrick Nilson (1840-1899), che lo chiamò scandio in onore della Scandinavia, e il secondo nel 1875 dal francese Paul-Émile Lecoq de Boisbaudran (1838-1912), che lo chiamò gallio dal nome latino del suo paese natale.
Con il passare degli anni e il progredire della chimica, vennero sintetizzati nuovi elementi che si andarono ad incastrare perfettamente nelle righe e nelle colonne della Tavola Periodica, che si rivelò così un grandissimo successo. Un successo tale da essere imitato in analoghe strutture ripetitive che cercano di dividere diverse realtà in gruppi omogenei, come dimostra (per restare in tema con la nostra lezione) questa straordinaria "Tavola Periodica dei Personaggi della Terra di Mezzo", che è stata tratta da questo sito. Ciò che Mendeleev non poteva prevedere era però il fatto che anche la sua Tavola, così come i fuochi d'artificio di Gandalf, permetteva di scrutare direttamente dentro la struttura degli atomi. Dopo l'ideazione del modello planetario dell'atomo, infatti, ci si è resi conto che gli elementi della Tavola sono ordinati esattamente per Numero Atomico crescente, dove per Numero Atomico (indicato con Z) si indica il numero di protoni contenuti nel nucleo atomico. Ma andiamo con ordine.
Sulla base delle ipotesi di Bohr, discusse nella lezione precedente, si è detto che, onde interpretare la cosiddetta struttura fine degli spettri, Arnold Sommerfeld ha perfezionato il modello atomico planetario, supponendo che ogni livello energetico (quantizzato dal numero quantico principale n) possa essere occupato da più orbite ellittiche di forma diversa, la cui eccentricità è quantizzata dal numero quantico angolare l, che può assumere solo n valori interi positivi compresi fra 0 ed n – 1. Ne consegue che:
1) il livello energetico o shell K, con n = 1, può contenere una sola orbita, con l = 0, che Sommerfeld riteneva perfettamente circolare, ed indicò con la lettera s;
2) il livello energetico L, con n = 2, può contenere due orbite, con l = 0 ed l = 1; la prima secondo Sommerfeld sarebbe circolare e la seconda ellittica, ed egli indicò quest'ultima con la lettera p. Ne consegue che la shell L può contenere solo le orbite s e p;
3) il livello energetico M, con n = 3, può contenere tre orbite, con l = 0, l = 1 ed l = 2; le prime due sono le già citate s e p, mentre la terza secondo Sommerfeld sarebbe un'altra orbita ellittica con eccentricità maggiore, indicata con la lettera d. Ne consegue che la shell M può contenere le orbite di tipo s, p, d;
4) il livello energetico N, con n = 4, può contenere quattro orbite, con l = 0, l = 1, l = 2 ed l = 3; le prime tre sono le già citate s, p e d, mentre la quarta secondo Sommerfeld sarebbe un'ulteriore orbita ellittica con eccentricità ancora più pronunciata, indicata con la lettera f. Ne consegue che la shell N può contenere le orbite di tipo s, p, d, f.
Le orbite con l pari a 4, 5 e 6 sarebbero indicate con le lettere g, h ed i. Attualmente in natura non sono noti elementi con elettroni in queste orbite; tuttavia un elettrone eccitato, per esempio per mezzo di una radiazione elettromagnetica, può andare ad occupare una configurazione orbitale definita da l maggiore di 3.
In seguito all'esperimento di Stern e Gerlach del 1921 si scoprì che anche l'orientamento delle orbite nello spazio risulta quantizzato attraverso un terzo numero quantico detto numero quantico magnetico m, che può assumere i valori interi e positivi compresi fra – l e + l, incluso lo zero. Ne consegue che ogni singola orbita, la cui eccentricità è definita da un ben preciso valore di l, può assumere un totale di ( 2 l + 1 ) orientamenti nello spazio per effetto dell'applicazione di un campo magnetico esterno. Ne consegue che l'orbita s può avere un solo orientamento spaziale, l'orbita p ne può avere tre, l'orbita d ne può avere cinque e l'orbita f ne può avere sette. Il quarto numero quantico s, detto di spin, fu introdotto nel 1925 da Uhlembeck e Goudsmit, i quali si resero conto che l'elettrone, ad un momento angolare orbitale, ne possiedono anche uno intrinseco, che può assumere solo i valori + 1/2 h/ 2π oppure –1/2 h/ 2π , da cui si deducono i due possibili valori ± 1/2 del numero quantico s. Come abbiamo già detto, Wolfgang Pauli interpretò il momento angolare di spin come dovuto alla rotazione dell'elettrone sul proprio asse, ma Dirac scoprì invece che si tratta di un fenomeno puramente relativistico.
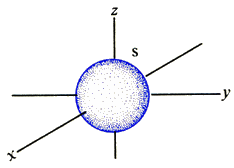
La formulazione della Meccanica delle Matrici (1925) di Werner Heisenberg e della Meccanica Ondulatoria (1926) di Erwin Schrödinger, seguite poi dalla più complicata Meccanica degli Operatori (1926) di Paul Dirac, portarono però all'abbandono del concetto di orbita classica, che non avrebbe più senso in un mondo nel quale vale il Principio di Indeterminazione di Heisenberg, ed alla sua sostituzione con il concetto di orbitale. Esso indica la regione di spazio nella quale vi è una determinata probabilità di trovare l'elettrone. Risolvendo l'equazione di Schrödinger per l'atomo di idrogeno (i calcoli però sono tutt'altro che semplici), emergono in modo naturale i numeri quantici n, l ed m (s emerge dall'equazione di Dirac), ed è possibile anche determinare le forme assunte dagli orbitali che conservano i nomi di s, p, d, f, i quali ovviamente si discostano moltissimo da comuni orbite circolari od ellittiche. L'orbitale s, ad esempio, ha simmetria sferica, ed in teoria si estende sino all'infinito, perchè solo all'infinito la probabilità di trovare l'elettrone diventa zero:
L'orbitale p invece ha una curiosa forma a due lobi, che come detto possono presentare tre orientazioni spaziali, poiché l vale 1 ed m può assumere tre valori possibili: – 1, 0 e + 1. Si noti che l'elettrone passa da un lobo all'altro attraverso il nucleo per effetto tunnel, un fenomeno che non può avere luogo in un contesto classico, ma solo in un mondo dominato dalla meccanica quantistica:
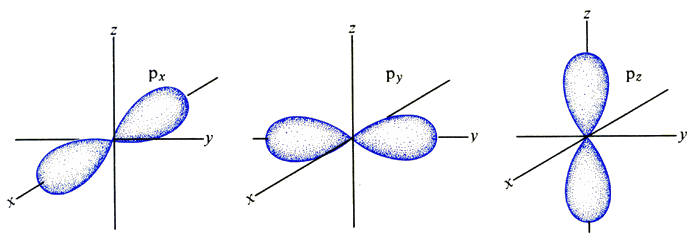
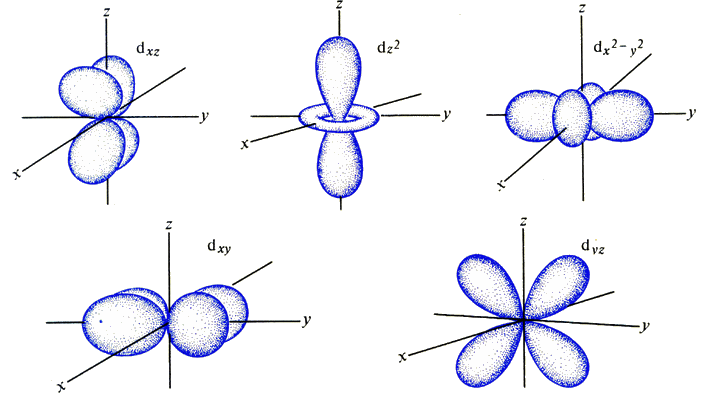
L'orbitale d invece ha una struttura a quattro lobi, che possono assumere cinque configurazioni spaziali, poiché l vale 2 ed m può assumere cinque valori possibili: – 2, – 1, 0, + 1 e + 2. Anche in questo caso, l'elettrone passa da un lobo all'altro per effetto tunnel. Si noti che in una delle cinque configurazioni, due lobi sono sostituiti da un anello, mentre in un'altra due lobi hanno forma diversa da quella degli altri due:
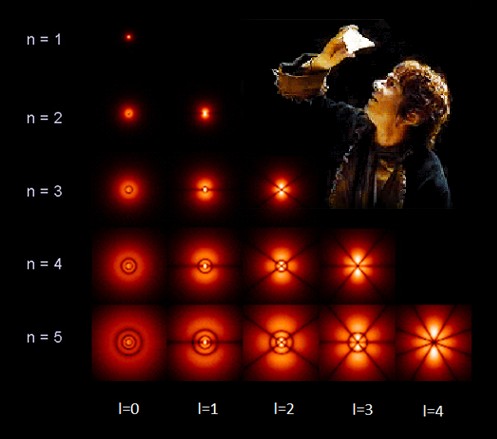
L'orbitale f invece ha una struttura a sei lobi, che possono assumere sette configurazioni spaziali, poiché l vale 3 ed m può assumere sette valori possibili: – 3, – 2, – 1, 0, + 1, + 2 e + 3, ma per semplicità non ne forniamo tutte le possibili rappresentazioni tridimensionali, e ci fermiamo qui. L'immagine sottostante, nella quale si vede anche lo hobbit Bilbo alle prese con l'archepietra, mostra le possibili forme "reali" dei vari orbitali nelle prime cinque shell elettroniche:
Tali orbitali corrispondono agli "stati stazionari" introdotti da Bohr. Mentre però Niels Bohr non aveva spiegato perchè l'elettrone può orbitare in essi senza perdere energia, la Meccanica Quantistica risponde perfettamente a questa domanda: gli orbitali vengono chiamati anche autostati del sistema quantistico rappresentato dall'atomo di idrogeno, perché rappresentano le cosiddette autosoluzioni dell'Equazione di Schrödinger, autosoluzioni a cui corrisponde un livello di energia costante! Si dice anche che gli orbitali sopra rappresentati costituiscono una base completa per descrivere tutti gli stati del sistema, che sono rappresentati da una loro combinazione lineare. Questo però vale se l'elettrone è uno solo, come nell'atomo d'idrogeno o nei cosiddetti atomi idrogenoidi, che sono ionizzati positivamente e possiedono un elettrone solo come l'idrogeno. Invece, quando ci sono due o più elettroni che interagiscono fra di loro, questi orbitali non sono più autostati del sistema quantistico. Siccome il sistema (classico o quantistico che sia) cerca di portarsi nello stato di energia minima, l'orbitale s e gli orbitali p possono dar luogo a combinazioni lineari la cui energia è minore di quella degli autostati di partenza, che vengono chiamati in gergo orbitali ibridi. Senza di essi, non è possibile spiegare la configurazione spaziale delle molecole, realizzate tramite legami covalenti tra gli orbitali atomici; ma di questo riparleremo più avanti.

Per ora, dedichiamoci a questi autostati e vediamo come, grazie ad essi, è possibile costruire le configurazioni elettroniche di tutti gli atomi conosciuti. Questo procedimento prende il nome di Aufbau, in tedesco "costruzione" (Aufbau è un sostantivo e perciò è scritto in maiuscolo). Esso si basa sul cosiddetto Principio di Esclusione, formulato nel 1925 da Wolfgang Pauli (1900-1958), già famoso per aver scritto a soli vent'anni un trattato sulla Relatività che è tuttora un classico in materia. Tale Principio afferma che in un atomo non possono trovarsi due elettroni che hanno tutti e quattro i numeri quantici uguali. Un corollario fondamentale di questo Principio aggiunge che nello stesso orbitale non possono trovarsi mai più di due elettroni. Ogni orbitale è infatti caratterizzato univocamente da una terza ( n, l, m ), e il quarto numero quantico s può assumere solo i due valori ± 1/2. L'Aufbau atomico segue inoltre altre due regole:
1) in condizioni normali, gli
elettroni di un atomo occupano sempre i livelli energetici per cui l'energia
dell'atomo risulta minima;
2) gli elettroni in un atomo tendono a disporsi con il numero
massimo possibile di spin paralleli tra di loro. Quest'ultima è nota
come regola di Hund, in onore del fisico tedesco Friedrich Hund
(1896-1997).
Ogni livello energetico (corrispondente a un valore ben preciso di n) può contenere un numero di elettroni pari a:
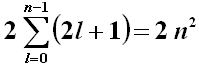
infatti ( 2l + 1 ) è il numero dei possibili valori di m per ogni orbitale l, mentre il fattore 2 deriva dal fatto che in ogni orbitale possono trovarsi al massimo due elettroni, con spin opposti. La sommatoria or ora scritta può essere facilmente calcolata ricorrendo alle progressioni aritmetiche, oppure osservando che ( 2l + 1 ) è un numero dispari, e la somma dei primi n numeri dispari è pari al quadrato di n. La shell K, con n = 1, può contenere appena 2 elettroni; la shell M, con n = 2, ne può contenere al massimo 8; la shell M, con n = 3, ne può contenere al massimo 18; la shell N, con n = 4, ne può contenere al massimo 32; la shell O, con n = 5, ne può contenere al massimo 50; e così via. Questi numeri non vi ricordano qualcosa? Mi sto riferendo in particolare alla Tavola Periodica. Se non avete ancora una risposta per questa domanda, la avrete tra poco, seguendomi nel mio ragionamento.
Dunque, nel livello K si ha n = 1, quindi l può valere solo 0 ed m a sua volta può valere solo 0. Conclusione: la shell K contiene un solo orbitale, che nella notazione di Sommerfeld indicheremo con 1s, e in quella di Pauli con ( 1 ; 0 ; 0 ). Tale orbitale può contenere al massimo due elettroni, quindi avremo solo due possibili elementi, uno con un elettrone e l'altro con due:
È evidente che abbiamo realizzato l'idrogeno (Z = 1) e l'elio (Z = 2). Questi due elementi vennero allora collocati da Bohr nella prima riga in alto della Tavola Periodica, che contiene gli atomi in grado di riempire al massimo la shell K. Passiamo ora alla shell L. Essa ha n = 2, quindi l può avere due valori, 0 o 1. Il primo corrisponde all'orbitale indicato da Sommerfeld con 2s e da Pauli con ( 2 ; 0 ; 0 ), mentre il secondo a 2p. 2s come visto può contenere al massimo due elettroni, mentre 2p può assumere tre configurazioni spaziali, perchè ad l = 1 corrispondono tre possibili valori d m: – 1, 0, + 1. Ne consegue che 2p contiene in realtà tre orbitali, indicati da Sommerfeld con le notazioni 2px, 2py, 2pz e da Pauli con ( 2 ; 1 ; – 1), ( 2 ; 1 ; 0 ) e ( 2 ; 1; 1 ). In tutto la shell K contiene dunque quattro orbitali, per un totale di 8 elettroni, e quindi di 8 nuovi atomi. Cominciamo con il 2s, dando per scontato che 1s sia già pieno. Avremo un atomo con tre elettroni e un altro con quattro, che corrispondono al litio (Z = 3) e al berillio (Z = 4):
Se vogliamo andare oltre, dobbiamo riempire i tre orbitali 2p. Secondo la regola di Hund, andrà prima un elettrone con spin up in 2px, poi uno con spin up in 2py, e infine uno con spin up in 2pz, in modo che i tre nuovi elettroni abbiano tutti gli spin paralleli tra di loro:
Abbiamo così il Boro (Z = 5), il Carbonio (Z = 6) e l'Azoto (Z = 7). Successivamente riempiremo i tre posti mancanti con tre elettroni dotati di spin down, e le configurazioni elettroniche dei nuovi atomi saranno le seguenti:
Questi sono rispettivamente l'Ossigeno (Z = 8), il Fluoro (Z = 9) e il Neon (Z = 10). Si noti che quest'ultimo, come l'elio, ha il livello più esterno assolutamente pieno, e quindi non può formare assolutamente legami con altri atomi; per questo si parla di gas nobili (anche i nobili di una volta non volevano mescolare il loro sangue con quello dei plebei). Di conseguenza, Bohr dispose il neon sotto l'elio. Il litio, che ha un solo elettrone nel livello più esterno, si comporterà chimicamente come l'idrogeno, e così lo pose sotto di esso. Distanziò in seguito le due colonne, ed infilò tra di esse gli altri sei elementi: berillio, boro, carbonio, azoto, ossigeno e fluoro. Era così riempita anche la seconda riga della Tavola Periodica, che contiene gli atomi in grado di riempire al massimo la shell L.
Passiamo ora alla shell M. Essa ha n = 3, quindi l può avere tre valori: 0, 1 o 2. Il primo corrisponde all'orbitale indicato da Sommerfeld con 3s e da Pauli con ( 3 ; 0 ; 0 ), mentre il secondo a 3p e il terzo a 3d. 3s come visto può contenere al massimo due elettroni, e 3p altri sei, contenendo tre orbitali indicati da Sommerfeld con le notazioni 3px, 3py, 3pz e da Pauli con ( 3 ; 1 ; – 1), ( 3 ; 1 ; 0 ) e ( 3 ; 1; 1 ). Avremo così otto nuovi elementi, il cui riempimento è assolutamente analogo a quelli del livello L:
Si tratta del Sodio (Z = 11), del Magnesio (Z = 12), dell'Alluminio (Z = 13, vedi più sotto), del Silicio (Z = 14), del Fosforo (Z = 15), dello Zolfo (Z = 16), del Cloro (Z = 17) e dell'Argon (Z = 18). Ciascuno di questi sei elementi ha la stessa configurazione elettronica esterna degli otto che vanno dal Litio al Neon, e così Bohr dispose il sodio sotto il litio, il magnesio sotto il berillio, l'alluminio sotto il boro, il silicio sotto il carbonio, il fosforo sotto l'azoto, lo zolfo sotto l'ossigeno, il cloro sotto il fluoro e l'argon sotto l'elio e il neon, in questo modo:
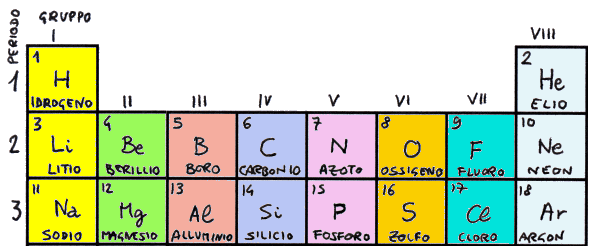
A questo punto appare chiaro che il riempimento (Aufbau) della Tavola Periodica segue passo passo la configurazione elettronica degli atomi, e quindi è un ulteriore modo per guardare dentro gli atomi stessi! Idrogeno, litio e sodio fanno parte di un gruppo di elementi chiamati alcalini (dalla parola araba Al Qali, che indica la soda caustica o idrossido di sodio); berillio e magnesio fanno parte dei cosiddetti elementi alcalino-terrosi; fluoro e cloro fanno parte dei cosiddetti alogeni ("generatori di sali"), e dei gas nobili si è già detto. Ogni riga della Tavola Periodica, detta periodo, rappresenta una shell atomica, ed ogni colonna un gruppo (qui sopra sono numerati con numeri romani da I ad VIII), composto da elementi con la stessa configurazione elettronica esterna, e quindi con le stesse proprietà chimiche. Ad esempio, nella famosa puntata della Serie Originale di "Star Trek" intitolata "Il mostro dell'oscurità" e nel film britannico "Island of Terror" (1966) sono descritti esseri la cui biologia è a base di silicio, non di carbonio (il suddetto film li chiama Siliconi, perchè silicio in inglese si dice "silicon"), ed anche biologi seri ammettono che la possibilità di una vita basata sul silicio è tutt'altro che ridicola, dato che i due elementi appartengono allo stesso gruppo, il quinto, ed hanno dunque le stesse proprietà chimiche!
A questo punto, dovremmo riempire gli orbitali 3d... e invece no! L'elemento successivo all'argon, e cioè il potassio, ha le stesse proprietà chimiche del litio e del sodio; insomma, è un metallo alcalino. Ciò significa che è stato riempito l'orbitale 4s, prima del 3d! Perchè? In base alla regola secondo cui sono riempiti prima gli orbitali con energia minore, e si può verificare che il 4s ha energia minore degli orbitali 3d. Ne consegue che si ottengono gli elementi noti come Potassio (Z = 19) e Calcio (Z = 20), che vanno collocati rispettivamente sotto il sodio e sotto il magnesio:
Se a questo punto pensate che vengano riempiti i tre orbitali 4px, 4py e 4pz, sono costretto a smentirvi, perchè essi hanno energia superiore al 3d. Tocca dunque prima a quest'ultimo. Esso però può assumere ben cinque configurazioni spaziali, perchè ad l = 2 corrispondono cinque possibili valori d m: – 2, – 1, 0, + 1, + 2. Ne consegue che 2p contiene in realtà tre orbitali, indicati da Pauli con le notazioni ( 3 ; 2 ; – 2 ), ( 3 ; 2 ; – 1 ), ( 3 ; 2 ; 0 ), ( 3 ; 2 ; 1 ) e ( 3 ; 2 ; 2 ). In tutto essi possono contenere 10 elettroni, per un totale di 10 nuovi atomi:
I nuovi elementi così prodotti sono lo Scandio (Z = 21), il Titanio (Z = 22, vedi più sotto), il Vanadio (Z = 23), il Cromo (Z = 24), il Manganese (Z = 25), il Ferro (Z = 26), il Cobalto (Z = 27), il Nichel (Z = 28), il Rame (Z = 29) e lo Zinco (Z = 30). Questi elementi vengono detti metalli di transizione o metalli del blocco d; essi hanno una resistenza meccanica molto alta, punti di fusione ed ebollizione piuttosto alti e buona conducibilità elettrica e termica, a causa della capacità degli elettroni dell'orbitale 3d di delocalizzarsi e viaggiare liberamente lungo il reticolo cristallino dei metalli. Solo a questo punto si riempiranno i tre orbitali 4px, 4py e 4pz, dando vita ad altri sei elementi:
Abbiamo così ottenuto il Gallio (Z = 31), il Germanio (Z = 32), l'Arsenico (Z = 33), il Selenio, (Z = 34), il Bromo (Z = 35) e il Kripton (Z = 36). Quest'ultimo è un gas nobile, perchè la configurazione elettronica esterna è completa. Invece, se si confrontano le precedenti strutture con quelle riportate sopra degli elementi che hanno riempito gli orbitali 3p, si arguirà immediatamente che il gallio va posto sotto boro e alluminio, il germanio sotto carbonio e silicio, l'arsenico sotto azoto e fosforo, il selenio sotto ossigeno e zolfo, il bromo sotto fluoro e cloro, e il kripton sotto elio, neon e argon. E i dieci elementi ottenuti riempiendo gli orbitali 3d? Essi hanno proprietà diverse da quelle di tutti gli altri atomi visti finora, e quindi Bohr separò tra di loro i primi due gruppi dagli ultimi sei, inserendo in essi i metalli del blocco d:
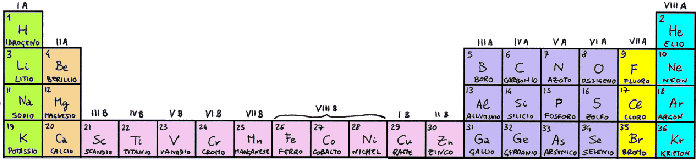
Come si vede, in verde abbiamo indicato gli alcalini più l'idrogeno, che hanno un elettrone nell'orbitale s più esterno; in arancione gli alcalino-terrosi, con due elettroni nell'orbitale s più esterno, escluso l'elio; questi due gruppi formano il cosiddetto blocco s. In blu, in giallo (questi sono gli alogeni) e in azzurro (questi ultimi sono i gas nobili) vi sono gli elementi del blocco p, che hanno elettroni negli orbitali p più esterni. In fucsia infine abbiamo gli elementi del blocco d. Fu così che Bohr venne a disegnare una tavola periodica di forma invero insolita, ma il cui aspetto riflette alla perfezione l'Aufbau atomico!
Non preoccupatevi, non vi annoierò con tutte le configurazioni elettroniche di tutti gli elementi della tavola periodica: ormai avete capito il giochetto, e dovreste essere in grado di costruirvele da soli. Naturalmente, a patto di sapere quale orbitale verrà riempito dopo i 4p. L'ordine preciso è dato dalla cosiddetta Regola di Madelung, dal nome del suo scopritore Erwin Madelung (1881-1972): gli orbitali con un valore più basso di ( n + l ) vengono riempiti prima di orbitali con valori ( n + l ) maggiori. In altre parole, gli orbitali si riempiranno seguendo le frecce rosse diagonali di questa pergamena:

La regola si fonda sul numero totale di nodi nell'orbitale atomico, numero che è dato da ( n + l ) e che è correlato all'energia dell'orbitale stesso. In caso di valori uguali di ( n + l ), l'orbitale con un valore di n minore viene riempito per primo. La regola ha alcune eccezioni, come ad esempio il palladio, ma si è dimostrata in ottimo accordo con l'esperienza. In base alla regola di Madelung, l'orbitale 4s (n + l = 4 + 0 = 4) viene occupato prima degli orbitali 3d (n + l = 3 + 2 = 5), esattamente come abbiamo visto sopra. Dopo i 4p, ad essere occupato per primo sarà il 5s, cui seguiranno i 4d, i 5p, il 6s, e solo a questo punto, quando Z avrà già toccato quota 56, verrà riempito il primo orbitale di tipo f, per la precisione il 4f. Il blocco f degli elementi andrebbe dunque collocato fra il blocco s e il blocco d, ma, per evitare di ottenere una tavola periodica esageratamente larga, Bohr lo collocò sotto la tavola usando degli asterischi. Ecco come appare oggi la tavola periodica, riorganizzata da Niels Bohr, con i blocchi indicati mediante colori omogenei (il blocco s in arancione, il blocco p in giallo, il blocco d in fucsia e il blocco f in azzurro):
Si clicchi su di essa, per vederne una versione più ampia. Nella prima riga del blocco f sono indicati i cosiddetti elementi lantanidi (in greco "nascosti") o terre rare, compresi fra il Lantanio (Z = 56) e il Lutezio (Z = 71), che riempiono gli orbitali 4f. Nonostante il nome, essi non sono rarissimi nella crosta terrestre (ad eccezione del Promezio che non ha isotopi stabili), ma furono chiamati così perchè estratti da minerali all'epoca poco comuni: la prima delle terre rare ad essere isolata fu il Cerio (Z = 58), scoperto nel 1803 in Svezia da Jöns Jacob Berzelius (1779-1848) e Wilhelm von Hisinger (1766-1852) ed in Germania, indipendentemente, da Martin Heinrich Klaproth (1743-1817). Invece nella seconda riga del blocco f sono indicati i cosiddetti attinidi, compresi fra l'Attinio (Z = 89) e il Laurenzio (Z = 103), che riempiono gli orbitali 5f. Le loro proprietà chimiche sono analoghe a quelle dei lantanidi, ma la maggior parte di essi non esistono in natura, e sono stati prodotti artificialmente dall'uomo mediante reazioni nucleari. L'elemento con Z più alto a noi noto è il cosiddetto Ununoctio o Ekaradon (Z = 118), così chiamato in via provvisoria attraverso la trascrizione latina delle cifre che compongono il suo numero atomico: "unus" (1), "unus" (1) e "octo" (8); la sua scoperta fu annunciata nel 2006 dai ricercatori russi del Joint Institute for Nuclear Research di Dubna e dagli americani del Lawrence Livermore National Laboratory in California, attraverso la collisione di atomi di californio e calcio. Il 30 dicembre 2015 la IUPAC (International Union of Pure and Applied Chemistry) ha confermato di aver verificato in modo attendibile la scoperta degli elementi 113, 115, 117 e 118 della Tavola Periodica, all'epoca chiamati ancora ununtrio, ununpentio, ununseptio e ununoctio, e il 9 giugno 2016 ha assegnato loro dei nomi. Essi sono rispettivamente; Nihonio (Nh, Z = 113), in onore del Giappone (è stato scoperto da scienziati nipponici guidati dal professor Kosuke Morita operando collisioni tra ioni di zinco e bismuto, e Nihon è il nome in giapponese del Paese del Sol Levante, che proprio questo significa); Moscovio (Mc, Z = 115), perchè a Mosca ha sede l’Istituto di Ricerche Nucleari di Dubna dove è stato sintetizzato; il Tennessinio (Ts, Z = 117), dedicato allo Stato del Tennessee, dove sorge il Laboratorio Nazionale di Oak Ridge della Vanderbilt University, il cui gruppo ha scoperto l'elemento; e infine l'Oganessio (Og, Z = 118), il settimo gas nobile scoperto, dedicato al professor Yuri Oganessian (1933-), studioso di elementi transuranici. È stata così finalmente completata la settima fila della Tavola. Tra l'altro, l'elemento 115 o Moscovio è citato nel videogioco "Tomb Raider III" (il meteorite che deve trovare Lara Croft contiene tale elemento)! Kosuke Morita del Riken si Tokyo ha dichiarato però che il suo gruppo di ricerca confida di « avviare nuove ricerche nei territori inesplorati oltre l’elemento 119 ». La caccia dunque prosegue.
La Tavola Periodica ha una fine? In altre parole, vi è un ultimo elemento al di là del quale non si può più procedere oltre? Ogni nuxcleo atomico esiste se la forza nucleare forte che tiene utili tra loro i nucleoni supera la repulsione coulombiana provocata dai protoni, tutti i di carica positiva. Ma la repulsione elettrostatica ha virtualmente raggio infinito, mentre la forza nucleare forte ha un raggio d'azione dell'ordine delle dimensioni di un protone, per cui riesce a legare solo neutroni tra di loro contigui. Ne consegue che, se il nucleo diventa troppo grosso, la repulsione tra le cariche positive dei protoni supera fatalmente la forza d'attrazione tra le cariche barioniche dei nucleoni (la carica barionica è l'entità in cui ha sede la forza nucleare forte, così come la carica elettrica è ciò in cui ha sede la forza elettromagnetica), e il nucleo diventa instabile; o, se preferite, radioattivo. L'ultimo elemento ad avere isotopi stabili è il piombo, con Z = 82; gli elementi successivi si trovano in natura solo perchè i loro isotopi hanno una vita media così lunga, da essere sopravvissuti fin dal tempo del Big bang, come l'Uranio (Z = 92), oppure fanno parte di catene di decadimento di questi ultimi: è il caso del Plutonio, con Z = 94. Tali isotopi si dicono primordiali. Ad essi può essere paragonata la lunghissima vita degli Elfi, che in alcuni casi sopravvivono fin dai primordi della Terra di Mezzo:
«
"Voi ricordate?" disse Frodo, esprimendo ad alta voce per lo stupore
il proprio pensiero. "Ma credevo", balbettò allorché Elrond si
volse verso di lui, "che la caduta di Gil-galad fosse avvenuta in epoca
molto lontana..."
"Infatti è così", rispose gravemente Elrond, "ma la mia
memoria risale fino ai Tempi Remoti. Eärendil fu mio padre, che nacque a
Gondolin prima della sua caduta; e mia madre fu Elwing, figlia di Dior, figlio
di Lúthien di Doriath. Ho visto tre ere ad ovest del mondo, molte sconfitte e
molte vittorie inutili. Fui araldo di Gil-galad e marciai con le sue schiere.
Partecipai alla Battaglia di Dagorlad innalzi al Cancello nero di Mordor, dove
la vittoria fu nostra..." »
(SdA, libro II, cap. II)
Non resisto alla tentazione di raccontarvi che, come hanno rivelato i suoi collaboratori David Clark e David Hobart, quando Glenn Theodore Seaborg (1912-1999) presso la University of California di Berkeley scoprì il Plutonio, propose per esso il simbolo "Pu" e non "Pl", che sarebbe stata la scelta più ovvia, « per l'analogia con il verso ("Pee-yoo") che fa un bambino quando sente l’odore di qualcosa di sgradevole »: "Pu" infatti in inglese si legge "pìu". David Seaborg, il figlio del famoso chimico, ha confermato la circostanza a Robert Krulwich del National Geographic: « pensò che fosse divertente trattare il plutonio come se fosse un elemento puzzolente ». E in seguito lo divenne davvero, visto l'uso che se ne fece nelle armi nucleari! Dopo averlo proposto alla IUPAC, Seaborg pensò che il suo simbolo scherzoso non avrebbe fatto molta strada. Sorprendentemente, invece, i commissari approvarono senza esitazione e senza obiezioni il "Pu" per il plutonio. E quel simbolo è in uso tuttora!
Al crescere del numero di nucleoni, i nuclei diventano sempre più instabili, e la loro emivita (cioè il tempo necessario affinché la metà esatta dei nuclei si disintegri) si accorcia sempre più. L'Uranio-235 ha una emivita di 4,47 miliardi di anni; il Plutonio-239 di 24.000 anni; il Californio-249 (Z = 98) di 351 anni; il Fermio-257 (Z = 100) di 100 giorni; il Nobelio-255 (Z = 102) di 3 minuti; il Bohrio-274 (Z = 107) di 54 secondi; il Darmstadtio-281 (Z= 110) di 11 secondi; il Flerovio-288 (Z = 114) di 0,8 secondi; il Livermorio-293 (Z = 116) di appena 61 millisecondi; e l'Ununoctio-294 o Eka-radon-294 (Z = 118) di soli 0,89 millisecondi! Appare evidente che, ad un certo punto, ulteriori isotopi avrebbero una vita media così corta, da disintegrarsi prima ancora di poter essere rilevati. Partendo da questa ipotesi, nel 1911 il chimico americano Elliot Quincy Adams (1888-1971) aveva previsto che non sarebbero potuti esistere elementi di massa atomica superiore a 256; come si è appena visto, la sua previsione si è rivelata troppo pessimistica, ma effettivamente i nuclei al di sopra di questa massa atomica hanno un'emivita così breve, che in chimica non possono avere alcuna utilità pratica. A sua volta il famoso Niels Bohr aveva previsto che non potrebbero esistere nuclei con numero atomico maggiore di 137, poiché il primo elettrone dell'orbitale 1s avrebbe dovuto viaggiare a velocità maggiore di quella della luce, ma la previsione ha poco senso perché il modello di Bohr, da noi discusso nella lezione precedente, è non relativistico, e non può essere applicato ad elementi i cui elettroni posseggono invece energie relativistiche. Usando invece l'equazione relativistica di Dirac si ottiene che l'energia di legame supera il proprio limite superiore per la prima volta nei nuclei con 173 protoni: per gli elementi più pesanti, se l'orbitale più interno non è riempito, il campo elettrico del nucleo spinge un elettrone al di fuori dell'atomo, determinando l'emissione spontanea di un positrone, ma questo non succede se l'orbitale più interno è riempito. Dunque l'elemento 173 non rappresenta necessariamente le Colonne d'Ercole della tavola periodica.
In ogni caso, nonostante l'emivita così breve dei nuclei con massa atomica superiore a 256, alcuni chimici pensano che esistano delle "isole di stabilità" al di là di questo limite; in altre parole, configurazioni particolarmente stabili dei nucleoni nel nucleo farebbero sì che alcuni elementi esistano con vita media assai più lunga di quella attesa; sono questi i cosiddetti elementi superpesanti. Quest'ipotesi fu avanzata per la prima volta dal già citato Glenn Theodore Seaborg, lo scopritore del Plutonio, in onore del quale è stato battezzato il Seaborgio, l'elemento con Z = 106. Una prima isola di stabilità è attesa attorno a una massa atomica di 300 circa, e il fisico russo Yuri Oganessian (1933-) sostiene che dovrebbe essercene una seconda intorno a Z = 164 (un valore davvero altissimo!), ma finora nessun isotopo di queste isole è stato scoperto. Nell'universo di Star Trek si postula che nel 2371 d.C. alla Federazione Unita dei Pianeti saranno noti 246 elementi e, come narrato nell'episodio "Post Mortem", l'equipaggio della "Voyager" scoprirà il 247-esimo nel suo viaggio di ritorno a casa, un isotopo con un nucleo formato da ben 550 nucleoni, e dunque davvero "obeso". Se la previsione sarà azzeccata, non ci resta che armarci di pazienza, ed attendere la scoperta di quegli elementi davvero superpesanti...

Una versione... circolare della Tavola Periodica, con un Palantír al centro!
Vediamo ora se è possibile eseguire l'esercizio contrario; cioè, preso un elemento qualsiasi della Tavola Periodica, ricostruire la sua configurazione elettronica utilizzando le regole sopra esposte. Scegliamo a questo punto l'argento. Perchè proprio l'argento? Perchè, a parte l'oro, è uno dei metalli più citati nel Legendarium di Tolkien. Di argento sono le cinture dei Nani Fili e Kili, quando essi mettono piede per la prima volta nella caverna di Bilbo:
«
"Stavolta è Gandalf senz'altro", pensò mentre sbuffava nel
corridoio. Invece no: erano altri due Nani, entrambi con cappucci blu,,
cinture d'argento
e barba gialla; e ciascuno di essi portava un sacco di attrezzi e una vanga. »
(Lo Hobbit, cap. I)
D'argento sono le corde delle arpe magiche che i Nani trovano nella sala del tesoro del loro Regno sotto la Montagna, durante l'assenza di Smaug:
«
Fili e Kili erano quasi di buon umore, e trovando che molte arpe d'oro dalle
corde d'argento
erano ancora appese lì, le presero e le sfiorarono: ed essendo magiche (e
inoltre non essendo mai state toccate dal drago, che aveva poco interesse per
la musica) erano ancora accordate. »
(Lo Hobbit, cap. XIII)
Il Celebrant o Argentaroggia, fiume che i membri della Compagnia dell'Anello seguirono per raggiungere Lórien da Moria, trae il suo nome dal fatto che le sue acque sono limpide come l'argento, ma probabilmente anche dal fatto di essere argentifero:
«
Un poco più in basso del lago incontrarono un profondo pozzo di acqua limpida
come cristallo. dal quale sorgeva un rivo che, dopo esser fluito su un labbro
di pietra, scorreva scintillando e gorgogliando giù per una ripida
scanalatura rocciosa. "Questa è la fonte ove sorge l'Argentaroggia",
disse Gimli. "Diviene presto un rapido fiume, ed accoglie molti torrenti
dei monti. La nostra strada la costeggia per molte miglia." »
(SdA, libro II, cap. VI)
D'argento è anche la spilla che la Dama Galadriel dona ad Aragorn, prima che egli lasci Lórien con tutta la Compagnia dell'anello:
«
"Ho qui qualcosa che forse porterà conforto al tuo cuore", disse
Galadriel: "mi fu consegnata affinchè te la dessi, qualora tu fossi
passato dalle nostre terre." Tolse dal grembo una grande pietra verde e
limpida, incastonata in una spilla d'argento
a forma di aquila con le ali distese; la tenne alla luce, e la gemma
sfavillava come il sole tra le foglie della primavera. »
(SdA, libro II, cap. VIII)
E questo metallo compare anche nella presentazione scritta sulla quarta di copertina del tomo unico del "Signore degli Anelli" presso l'editrice Bomoiani:
« "Il Signore degli Anelli" è un romanzo di avventure in luoghi remoti e terribili, di episodi d'inesauribile allegria, di segreti paurosi che si svelano a poco a poco, di draghi crudeli e alberi che camminano, di città d'argento e di diamante poco lontane da necropoli tenebrose in cui dimorano esseri che spaventano al solo nominarli, di eserciti luminosi e oscuri. Tutto questo in un mondo immaginario ma ricostruito con cura meticolosa, e in effetti assolutamente verosimile, perché dietro i suoi simboli si nasconde una realtà che dura oltre e malgrado la storia: la lotta, senza tregua, fra il bene e il male. »
Ma non è tutto: ci ricorda l'argento anche il mithril, detto anche Argentovero o Argento di Moria, è il più leggendario tra tutti i metalli dell'universo partorito dalla fantasia di John Ronald Reuel Tolkien. Leggiamo la descrizione che ne danno Gandalf e Gimli, attraversando le miniere di Moria, dalle quali per l'appunto un tempo il mithril era estratto:
«
La ricchezza di Moria non era nell'oro o nei gioielli, gingilli dei Nani; non
era nel ferro, loro schiavo. Tali cose, e vero, abbondano qui; e specialmente il ferro.
Ma non era necessario che essi scavassero per procurarseli: tutto ciò che
desideravano potevano ottenerlo con il commercio. Codesto è infatti l'ultimo
posto al mondo ove si trovi l'argento di Moria o, come l'hanno chiamato
alcuni, l'argentovero: mithril è il nome elfico, mentre il nome dato dai
Nani non viene divulgato. Il suo valore era dieci volte superiore a quello
dell'oro, ed ora è inestimabile. [...] Mithril! Tutti i popoli lo
desideravano. Poteva lavorarsi come rame, e lucidarsi come vetro; ed i Nani
sapevano trasformarlo in un metallo leggero ma più duro dell'acciaio
temperato. Aveva la bellezza del comune argento, ma non si offuscava, né si
oscurava mai. Gli Elfi l'amavano teneramente, e fra i molti altri usi che ne
facevano, vi era la fabbricazione dell'ithildin o stellaluna, che vedeste
brillare sulla porta d'ingresso. »
(SdA, libro II, cap. IV)

Bilbo regala a Frodo la sua cotta di mithril
Nelle opere di Tolkien, il mithril è dunque descritto come una varietà di argento, lavorato però in qualche particolare modo così da renderlo estremamente resistente e al tempo stesso leggerissimo. Il maggiore esperto nella lavorazione del Mithril nella Prima Era fu Fëanor, il leggendario costruttore dei Silmaril, mentre nella Terza Era questo privilegio spettava ai Nani, come si legge nel brano qui sopra riportato. Proprio dai Nani Bilbo ebbe in dono una cotta di maglia in mithril come ricompensa per l'aiuto fornito loro per riconquistare la Montagna Solitaria; tale cotta viene poi ereditata da Frodo, e a quest'ultimo salverà la vita nelle miniere di Moria (in un passo giustamente famoso, Gandalf asserisce che quella cotta di mithril ha un valore superiore a quello dell'intera Contea!) L'idea di questa armatura preziosissima ed imperforabile viene dalla saga di Hervör, un ciclo di leggende norrene da cui Tolkien ha preso in prestito, tra l'altro, i nomi di Dwalin e Durin), in cui l'eroe Orvar-Odd indossa una cotta di maglia che nulla può perforare. Il mithril è così famoso, che è stato ripreso in numerose altre ambientazioni fantasy, ad esempio nel noto videogame Final Fantasy.
Pur senza essere dotato delle magiche proprietà del mithril, anche nel nostro universo l'argento è considerato uno dei metalli più nobili e preziosi del pianeta. Nella crosta terrestre vi sono 0,08 grammi di argento per tonnellata, una quantità 20 volte superiore a quella dell'oro (0,004 grammi per tonnellata). L'argento si trova in natura sia allo stato nativo che in minerali come l'argentite (Ag2S) o l'argentopirite (AgFe2S3); grandi giacimenti d'argento si trovano in Canada, Australia, Stati Uniti, Messico e Perù; in Italia è presente nei giacimenti del Sarrabus in Sardegna. Noto fin dall'antichità (è già menzionato in testi cuneiformi del III millennio a.C.), il suo nome è collegato al greco αργός, "splendente". Le prime monete d'argento risalgono al VII secolo a.C., ed ancor oggi in francese "argent" è sinonimo di "denaro". Con questo metallo lucidato venivano realizzati gli specchi e le posate; ancor oggi i servizi di posate vengono chiamati "argenteria". Nel Perù precolombiano vi erano ricchissime miniere d'argento, poi sfruttate dagli spagnoli. L'argento dà il nome ad una nazione, l'Argentina, ed al suo principale fiume, il Rio de la Plata ("Fiume dell'Argento"). Le prime lastre fotografiche erano realizzate con bromuro d'argento, che ha la proprietà di essere fotosensibile, ed oggi alcune tra le migliori batterie in commercio sono del tipo argento-zinco e argento-cadmio; Il fulminato d'argento è usato come esplosivo, mentre lo ioduro d'argento è usato per inseminare le nubi e stimolare la provocare la pioggia. Alcuni composti, come il nitrato d'argento, possono essere nocivi per la salute umana. L'argento ha la più alta conducibilità elettrica tra tutti i metalli, superiore persino a quella del rame. Nel Buddhismo è il secondo dei sette tesori, e simboleggia la virtù. In molte cosmogonie, l'argento è associato alla luna e a divinità lunari. Secondo la tradizione, un licantropo poteva essere ucciso solo con proiettili d'argento, una lama d'argento o un bastone d'argento. Un tempo si credeva che il mercurio fosse una varietà liquida dell'argento, da cui il nome tradizionale di "argento vivo"; in latino si dice hydrargyrium ("argento liquido"), donde viene il suo simbolo chimico Hg. D'argento sono le posate e i candelabri che il vescovo Myriel regala a Jean Valjean nei "Miserabili" (1862) di Victor Hugo (1802-1885), e persino uno dei racconti del "Sistema Periodico" (1975) di Primo Levi (1919-1987) si incentra sull'argento.
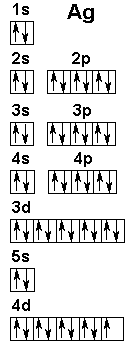 Costruiamo
dunque la configurazione elettronica dell'argento. Come si vede nella Tavola
Periodica di Bohr sopra riportata, esso si trova all'incrocio tra la quinta
riga dall'alto (Quinto Periodo) e l'undicesima colonna da sinistra (Gruppo I
B; si noti che i Gruppi del blocco p sono designati con lettera A,
quelli del blocco d con la lettera B). Siamo dunque nel blocco d. Onde
evitare di ricostruire tutta la configurazione degli orbitali a partire da 1s,
si parte dalla struttura del gas nobile precedente, che è il kripton,
e si scriverà [Kr] intendendo la sua intera configurazione, da noi
già costruita sopra. Seguendo la Regola di Madelung,
dopo l'orbitale 4p, l'ultimo riempito dal kripton, tocca agli orbitali 5s
e 4d. 5s è stato sicuramente riempito (dagli elementi Rubidio e
Stronzio), successivamente per arrivare all'argento occorre contare nove
metalli del blocco d, dunque nell'orbitale 4d dovremo sistemare altri nove
elettroni. La configurazione elettronica dell'argento si scriverà dunque [Kr]
5s2 4d9. Rappresentandola come abbiamo fatto per i
primi 36 elementi, avremmo un complicato schema come quello raffigurato qui a
sinistra.
Costruiamo
dunque la configurazione elettronica dell'argento. Come si vede nella Tavola
Periodica di Bohr sopra riportata, esso si trova all'incrocio tra la quinta
riga dall'alto (Quinto Periodo) e l'undicesima colonna da sinistra (Gruppo I
B; si noti che i Gruppi del blocco p sono designati con lettera A,
quelli del blocco d con la lettera B). Siamo dunque nel blocco d. Onde
evitare di ricostruire tutta la configurazione degli orbitali a partire da 1s,
si parte dalla struttura del gas nobile precedente, che è il kripton,
e si scriverà [Kr] intendendo la sua intera configurazione, da noi
già costruita sopra. Seguendo la Regola di Madelung,
dopo l'orbitale 4p, l'ultimo riempito dal kripton, tocca agli orbitali 5s
e 4d. 5s è stato sicuramente riempito (dagli elementi Rubidio e
Stronzio), successivamente per arrivare all'argento occorre contare nove
metalli del blocco d, dunque nell'orbitale 4d dovremo sistemare altri nove
elettroni. La configurazione elettronica dell'argento si scriverà dunque [Kr]
5s2 4d9. Rappresentandola come abbiamo fatto per i
primi 36 elementi, avremmo un complicato schema come quello raffigurato qui a
sinistra.
Da notare che, secondo alcuni esperti del sito Tolkien Gateway, l'equivalente del mithril nel nostro universo non è l'argento, bensì il titanio, che ha un colore bianco-argenteo brillante, è uno dei più resistenti tra i metalli, ha una densità pari alla metà di quello del ferro (ciò renderebbe la cotta di Bilbo e Frodo ad un tempo resistente e leggera), ed è chimicamente inerte, cioè non è corroso da alcun agente col passare del tempo. Inoltre, come il mithril è anche eccezionalmente raro e prezioso, in quanto in genere non si trova mai allo stato nativo nella crosta terrestre; i minerali da cui si estrae, come la brookite (biossido di titanio), la perovskite (ossido di calcio e titanio) e la titanite (ossido di calcio, titanio e silicio) in realtà sono abbondanti sulla crosta terrestre, ma la tecnologia per estrarre il titanio metallico da questi minerali è diventata conveniente solo nel XX secolo, quando il suo uso è cresciuto in maniera esponenziale nella moderna metallurgia. È stata avanzata l'ipotesi che quella sotto la montagna di Moria fosse una grande formazione di titanio metallico pressoché puro, separatosi dai suoi minerali quando Melkor innalzò rapidamente quella catena montuosa per cercare di respingere l'assalto dei Valar, ma ovviamente si tratta di illazioni degli appassionati.
Altri hanno proposto altri candidati a ricoprire il ruolo del mitologico metallo. Ad esempio il platino ha aspetto bianco-argento ed è estremamente resistente alla corrosione, ma con una densità di 21450 Kg/m3 (contro 10490 dell'argento e soli 4500 del titanio!) è sfortunatamente troppo pesante per farne armature leggere da portare. C'è chi ha proposto l'alluminio, che è l'elemento metallico più abbondante nella crosta terrestre, è leggerissimo (ha una densità di appena 2700 Kg/m3), è estremamente resistente ed è chimicamente troppo reattivo per esistere in natura allo stato nativo. Nel 1827 fu isolato allo stato metallico da Friedrich Wöhler (1800-1882), ma inizialmente era così difficile isolarlo, che era considerato un metallo prezioso proprio come argento e platino: Napoleone III di Francia acquistò stoviglie di alluminio, perché era più costoso dell'oro! Solo nel 1887 l'austriaco Karl Josef Bayer (1847-1904) mise a punto il procedimento elettrolitico industriale per estrarre l'alluminio dal suo principale minerale, la bauxite (idrossido di alluminio), che rese disponibile questo metallo su larga scala.
Ora, la configurazione elettronica dell'alluminio e quella del titanio sono già state costruite in precedenza, e possono essere sintetizzate rispettivamente con le scritture [Ne] 3s2 3p1 e [Ar] 4s2 3d2. Quella del platino invece è da realizzare ex novo; proviamoci, anche se come abbiamo detto è improbabile che esso abbia niente a che vedere con il mithril. Esso si trova all'incrocio tra la sesta riga dall'alto (Sesto Periodo) e la decima colonna da sinistra (Gruppo VIII B); siamo ancora nel blocco d. Anche stavolta si parte dalla struttura del gas nobile precedente, che è lo xeno, e si scriverà [Xe]. seguito dagli orbitali successivamente riempiti. Siccome lo xeno come ultimo orbitale riempie il 5d, per la Regola di Madelung dovremo occupare in successione gli orbitali 6s, 4f e 5d. I primi due risultano pieni, rispettivamente con 2 e 14 elettroni, mentre nel terzo avremo otto elettroni, essendoci otto elementi tra il bordo sinistro del blocco d e il platino nella Tavola di Bohr. Di conseguenza la configurazione cercata sarà [Xe] 6s2 4f14 5d8. La struttura con caselline e freccette ad indicare gli orbitali e gli elettroni la lascio da costruire come esercizio riassuntivo ai lettori.

A Paperino è spuntato... il bernoccolo della chimica!
Un altro famoso metallo "misterioso" citato nel Legendarium è il galvorn, la lega inventata da Eöl detto l'Elfo Scuro, il grande fabbro che visse in Nan Eloth e fu padre di Maeglin:
« E fabbricò un metallo duro come l'acciaio dei Nani, ma talmente malleabile, da poterlo rendere sottile e duttile, benché continuasse a essere impenetrabile a ogni sorta di lama o dardo. Lo chiamò galvorn poiché era nero e lucente come
giaietto, e ogni qualvolta si metteva in viaggio se ne ricopriva. »
(QS, cap. XVI)
Il termine significa "nero brillante" in lingua Sindarin. Con questo metallo il fabbro elfico Eöl forgiò le spade Anglachel e Anguirel; ma di che sostanza si tratta? Una possibile risposta la troviamo alcuni capitoli più avanti nello stesso Silmarillion:
«
Beleg scelse allora Anglachel; ed era una spada di gran pregio, essendo il suo
nome dovuto al fatto di essere forgiata da ferro caduto dal cielo in forma di stella fiammeggiante;
era tale da spezzare qualsiasi ferro tratto dal suolo... »
(QS, cap. XXI)
Dunque il galvorn potrebbe essere ferro meteoritico. Del resto, molto prima che gli uomini si impossessassero dei segreti della siderurgia, i primi manufatti in ferro furono ottenuti battendo ferro di meteoriti; ed anche la celeberrima spada Excalibur del mito arturiano era fatta di questo metallo. Altri, invece, sostengono che il galvorn fosse un elemento transuranico, cioè con numero atomico superiore a quello dell'Uranio (Z = 92), e quindi artificiale, prodotto tramite reazioni nucleari. Questi elementi hanno tutti una vita media molto breve, ma gli Elfi, nella loro scienza, potrebbero averne trovato degli isotopi stabili, i cosiddetti elementi superpesanti, in grado di non decadere nonostante l'altissimo numero di protoni e neutroni nel loro nucleo. Consideriamo ad esempio l'Ekapiombo, detto anche Flerovio in onore del suo scopritore, il russo Georgy Flyorov (1913-1990), e sintetizzato a Dubna nel giugno 1999. Esso ha Z = 114 e si trova esattamente sotto il piombo; secondo alcuni, potrebbe avere delle proprietà metalliche. Se è così, lascio a voi come esercizio il compito di scrivere la configurazione completa del ferro, da noi già accennata in quel che precede, e quella del flerovio, sicuramente più complicata; aiutatevi con la tavola periodica raffigurata qui sopra. Troverete la soluzione in fondo a questa pagina.

Naturalmente gli atomi non
esistono isolati: si uniscono tra di loro a formare molecole oppure cristalli.
Le forze che tengono uniti gli atomi prendono il nome di legami chimici. Ma
come si formano? Il più semplice è il legame covalente,
che consiste in una coppia di elettroni messi in comune da due atomi, e fu
descritto per la prima volta dal chimico statunitense Gilbert
Lewis (1875-1946). Si considerino ad esempio due atomi di  idrogeno.
Ciascuno di essi è dotato di un solo elettrone, e cerca di raggiungere la
stabilità, rappresentata da due elettroni nell'orbitale1s, mettendo in
comune un elettrone con l'altro atomo. La coppia di elettroni appartiene ad
entrambi gli atomi, e quindi, come si vede qui a destra, i loro orbitali 1s si fondono tra di loro
dando vita ad un unico orbitale, detto orbitale
molecolare (in realtà gli orbitali molecolari possibili sono due, ma
uno di essi ha energia di legame troppo alta, e quindi non si forma). Lewis
rappresentò questo legame con il simbolo H – H oppure H : H,
dove il trattino o i due punti indicano la coppia di elettroni messi in
comune. L'elettrone ha la stessa probabilità di trovarsi attorno al primo o
al secondo dei due atomi, poiché essi sono identici.
idrogeno.
Ciascuno di essi è dotato di un solo elettrone, e cerca di raggiungere la
stabilità, rappresentata da due elettroni nell'orbitale1s, mettendo in
comune un elettrone con l'altro atomo. La coppia di elettroni appartiene ad
entrambi gli atomi, e quindi, come si vede qui a destra, i loro orbitali 1s si fondono tra di loro
dando vita ad un unico orbitale, detto orbitale
molecolare (in realtà gli orbitali molecolari possibili sono due, ma
uno di essi ha energia di legame troppo alta, e quindi non si forma). Lewis
rappresentò questo legame con il simbolo H – H oppure H : H,
dove il trattino o i due punti indicano la coppia di elettroni messi in
comune. L'elettrone ha la stessa probabilità di trovarsi attorno al primo o
al secondo dei due atomi, poiché essi sono identici.
Consideriamo ora una
molecola costituita da due atomi differenti, ad esempio idrogeno e cloro; essi
daranno vita ad acido cloridrico (HCl). Come si è visto, l'idrogeno ha
un solo elettrone nell'orbitale 1s, mentre il cloro (a parte gli
orbitali 1s, 2s, 2p e 3s completi) ha sette
elettroni nell'orbitale più esterno 2p. Mettendo in comune gli
orbitali più esterni, dunque, i due atomi danno vita a un orbitale molecolare
con 8 elettroni, e quindi particolarmente stabile. Però, a differenza della
molecola d'idrogeno H2, il cloro possiede una maggior forza
di  attrazione degli
elettroni rispetto all'idrogeno, per cui l'orbitale molecolare sarà
asimmetrico, come si vede a sinistra, e gli elettroni tenderanno a trovarsi
con maggiore probabilità attorno al primo che attorno al secondo. In questo
caso si parla di legame covalente polare, e la
molecola si trasforma in un dipolo, essendo il
cloro tendenzialmente negativo e l'idrogeno tendenzialmente positivo. La
capacità di legare gli elettroni a sé da parte degli atomi prende il nome di
elettronegatività, e fu introdotta da Linus
Pauling (1901-1994). Nella tavola periodica, l'elettronegatività
aumenta da sinistra verso destra, e dal basso verso l'alto; gli alcalini hanno
tendenzialmente i valori più bassi, gli alogeni quelli più alti. Pauling
attribuì all'idrogeno un valore di elettronegatività pari a 2,1, al sodio
0,9, al potassio 0,8, al calcio
1,0, al magnesio 1,2, al carbonio
2,5,
all'ossigeno 3,5, al bromo 2,9, al cloro
3,0, al fluoro 4,0.
attrazione degli
elettroni rispetto all'idrogeno, per cui l'orbitale molecolare sarà
asimmetrico, come si vede a sinistra, e gli elettroni tenderanno a trovarsi
con maggiore probabilità attorno al primo che attorno al secondo. In questo
caso si parla di legame covalente polare, e la
molecola si trasforma in un dipolo, essendo il
cloro tendenzialmente negativo e l'idrogeno tendenzialmente positivo. La
capacità di legare gli elettroni a sé da parte degli atomi prende il nome di
elettronegatività, e fu introdotta da Linus
Pauling (1901-1994). Nella tavola periodica, l'elettronegatività
aumenta da sinistra verso destra, e dal basso verso l'alto; gli alcalini hanno
tendenzialmente i valori più bassi, gli alogeni quelli più alti. Pauling
attribuì all'idrogeno un valore di elettronegatività pari a 2,1, al sodio
0,9, al potassio 0,8, al calcio
1,0, al magnesio 1,2, al carbonio
2,5,
all'ossigeno 3,5, al bromo 2,9, al cloro
3,0, al fluoro 4,0.
Nel caso della molecola di
HCl, la differenza di elettronegatività tra i due atomi è pari a 3,0 – 2,1
= 0,9; nella molecola dell'acqua (H2O) è pari a 3,5
– 2,1 = 1,4.
Se la differenza di elettronegatività tra i due atomi è dell'ordine di 1,7
- 2,0, allora non vengono messi in comune elettroni fra i due atomi, ma
l'atomo più elettronegativo strappa letteralmente elettroni all'atomo più
elettropositivo, e si formano due ioni, i quali si legano tra di loro per via
dell'attrazione coulombiana. Quindi si forma non il legame covalente, ma il legame
ionico.
L'esempio più noto è quello del cloruro di sodio; tra i due atomi infatti si
ha una differenza di elettronegatività pari a 3,0 –
0,9 = 2,1. Allora il cloro, che ha sette elettroni nello strato più
esterno, strappa al sodio l'unico elettrone esterno che esso ha, e si formano
i due ioni Na+ e Cl–, i quali si
attirano e si dispongono ai vertici di un reticolo cubico, detto cristallo
ionico, come si vede qui a destra. I cristalli ionici sono pessimi
conduttori di corrente elettrica, giacché tutti gli elettroni sono vincolati
ai rispettivi ioni e non possono andarsene a zonzo per il solido. Se però si
pone del cloruro di sodio in acqua, esso di discioglie rapidamente. Perchè?
Perchè i singoli ioni Na+ e Cl– vengono
immediata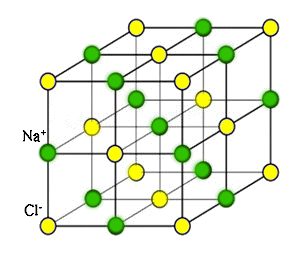 mente
circondati da molecole d'acqua, che sono fortemente polari: lo ione Na+
è circondato da molecole dalla parte dell'ossigeno, che in virtù della
maggiore elettronegatività assomma tutta la carica negativa, mentre lo ione Cl–
è circondato da molecole dalla parte dell'idrogeno, che è positivo. Si forma
il cosiddetto legame ione-dipolo, che ha energia
inferiore del legame ionico; e siccome la Natura cerca spontaneamente lo stato
ad energia minore, un cristallo di sale da cucina in acqua si discioglie
completamente. La soluzione ottenuta è fortemente conduttrice di
elettricità, perchè gli ioni negativi o anioni vengono attirati dall'anodo,
l'elettrodo positivo, mentre gli ioni positivi o cationi sono attratti dal catodo,
l'elettrodo negativo (anodo e catodo in greco significano rispettivamente
"strada in salita" e "strada in discesa").
mente
circondati da molecole d'acqua, che sono fortemente polari: lo ione Na+
è circondato da molecole dalla parte dell'ossigeno, che in virtù della
maggiore elettronegatività assomma tutta la carica negativa, mentre lo ione Cl–
è circondato da molecole dalla parte dell'idrogeno, che è positivo. Si forma
il cosiddetto legame ione-dipolo, che ha energia
inferiore del legame ionico; e siccome la Natura cerca spontaneamente lo stato
ad energia minore, un cristallo di sale da cucina in acqua si discioglie
completamente. La soluzione ottenuta è fortemente conduttrice di
elettricità, perchè gli ioni negativi o anioni vengono attirati dall'anodo,
l'elettrodo positivo, mentre gli ioni positivi o cationi sono attratti dal catodo,
l'elettrodo negativo (anodo e catodo in greco significano rispettivamente
"strada in salita" e "strada in discesa").
I metalli invece non danno vita né a legami covalenti né a legami ionici, ma a legami metallici. In pratica gli atomi metallici mettono in comune tutti i loro orbitali più esterni, nei quali gli elettroni possono scorrere liberamente lungo tutto il solido, assicurando così una forte conducibilità elettrica; per questo tali elettroni più esterni vengono detti elettroni di conduzione, mentre gli elettroni più profondi, che restano vincolati ai rispettivi atomi, prendono il nome di elettroni di valenza. In pratica un metallo può essere descritto come una struttura regolare di ioni positivi, immersi in una sorta di "gas" di elettroni mobili, che viene detto gas di elettroni di Fermi, poiché fu Enrico Fermi (1901-1955) a descriverlo per la prima volta. Gli elettroni di questo "gas" attirano gli ioni positivi, ed inoltre li schermano gli uni agli altri, impedendo che si respingano. Per questo il legame metallico è così intenso, come emerge dalle seguenti parole di Gandalf quando, all'inizio della Guerra dell'Anello, mette in guardia sul rischio che maneggiare l'Unico comporta:
«
Quanto a rompere l'Anello, la forza è del tutto vana. Anche colpendolo con
una mazza da fabbro, non lo scalfiresti nemmeno. Le tue mani e le mie mani mai
lo potranno disgregare. Questo piccolo fuoco non fonderebbe certo nemmeno
l'oro comune. L'Anello, nel bel mezzo di esso, non è stato minimamente
danneggiato e non si è nemmeno riscaldato... »
(SdA, libro I, cap. II)
Siccome però gli ioni metallici costituiscono un reticolo cristallino, gli strati di ioni possono scorrere gli uni sugli altri sotto l'azione di una forza esterna, e ciò spiega le proprietà di malleabilità (la capacità di essere ridotti in lamine sottili) e la duttilità (la proprietà di essere trasformati in lunghi fili) che sono caratteristiche dei metalli. Anche la tipica lucentezza metallica è conseguenza di questo legame, in quanto la moltitudine dei livelli energetici che costituiscono il gas di Fermi è in grado di assorbire e restituire un gran numero di frequenze dello spettro visibile, conferendo ai metalli il loro caratteristico aspetto.
Aggiungiamo che determinare per via teorica le caratteristiche dei vari livelli elettronici degli atomi pesanti e un'operazione complessa, perché occorre considerare gli effetti relativistici dovuti non solo al forte potenziale elettrico del nucleo, ma anche all'interazione fra gli elettroni nei diversi orbitali. Uno degli atomi più complessi da studiare è l'oro, che ha ben 79 elettroni, di cui fino a tempi recenti si avevano forti discrepanze fra i valori teorici e quelli sperimentali dell'energia di ionizzazione, l'energia necessaria a strappare un elettrone dall'atomo, e dell'affinità elettronica, l'energia necessaria ad aggiungerne uno. Tuttavia nel 2017 Peter Schwerdtfeger, della Massey University di Auckland in Nuova Zelanda, ha usato un nuovo approccio, che tiene conto non più di terne di elettroni, ma estende i calcoli all'interazione fra cinque elettroni, e grazie ad esso ha aumentato di un fattore dieci la precisione dei calcoli teorici sull'oro, riducendo la discrepanza fra i valori teorici e sperimentali di queste energie a pochi millielettronVolt. La forte interazione fra gli elettroni spiega anche il caratteristico colore dell'oro: gli effetti relativistici riducono il salto energetico fra gli orbitali 6s e 5d, dei quali abbiamo parlato sopra, portando l'oro ad assorbire le frequenze blu e a riflettere quelle gialle, il che giustifica l'ossessione dei Nani per questo metallo, ben sintetizzata dalla loro celebre canzone: « Lontan sui monti fumidi e gelati ( in antri fondi, oscuri, desolati, / prima che sorga il sol dobbiamo andare / a riaver l'arpe e l'oro a noi strappati » (Lo Hobbit, cap. I)!
Prima di passare oltre, fermiamoci un attimo a considerare alcune molecole la cui configurazione geometrica può essere interpretata solo alla luce di particolari strutture degli orbitali. Si consideri ad esempio la molecola dell'acetilene o etino, avente formula bruta C2H2, un gas incolore ed estremamente infiammabile, utilizzato per l'illuminazione delle miniere. La sua formula di struttura, ricostruita con un apposito kit disponibile presso i laboratori scolastici di chimica, è la seguente:

Come si vede, i quattro atomi sono allineati tra di loro. Questa struttura è spiegabile solo alla luce della cosiddetta ibridazione degli orbitali. Infatti, se si combinano linearmente le funzioni d'onda Ψ di un orbitale s e di uno p (qui sotto si è usato py), si ottengono due orbitali ibridi bilobati detti sp con una forma asimmetrica, tale che un lobo è assai maggiore dell'altro, e formanti tra di loro un angolo di 180°:
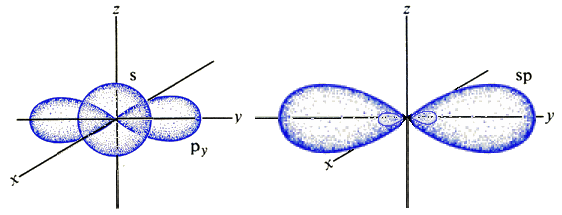
Applicando tutto questo ai due orbitali più esterni del carbonio, ne consegue che l'orbitale sp di sinistra forma un legame covalente con l'orbitale 1s dell'idrogeno, e l'orbitale sp di destra forma un legame covalente con l'altro atomo di carbonio. Siccome i due sp sono diametralmente opposti, si comprende facilmente perchè i quattro atomi della molecola di acetilene sono allineati! Naturalmente, ancora una volta questo avviene perchè gli orbitali ibridi sp hanno complessivamente energia minore degli orbitali s e p di partenza.
Prendiamo ora in considerazione la molecola di etilene o etene, avente formula bruta C2H4, anch'esso gassoso, incolore ed infiammabile, usato per produrre il polietilene. La sua formula di struttura è la seguente:
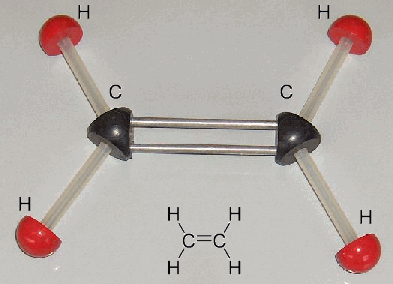
Come si vede, i tre legami C–H, C-H e C=C formano tra di loro angoli di circa 120°. Anche questa struttura è spiegabile solo alla luce dell'ibridazione degli orbitali, ma l'sp stavolta non va bene. Se invece si combinano linearmente le funzioni d'onda Ψ di un orbitale s e di due p, si ottengono tre orbitali ibridi bilobati detti sp2 disposti su un piano, e tali da formare tra di loro angoli di 120°:
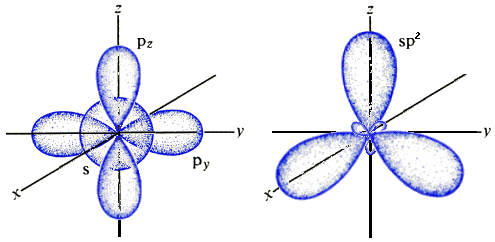
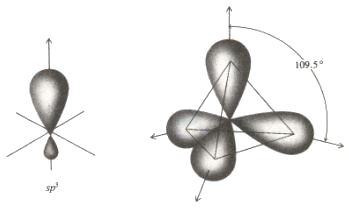
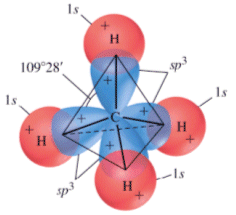
A questo punto voi mi chiederete: sono possibili anche orbitali ibridi sp3? La risposta è sì. Anzi, essi sono fondamentali per spiegare la formazione di una molecola ben nota come quella del metano, avente formula bruta CH4. Essa ha la forma di un tetraedro regolare, con l'atomo di carbonio al centro e quattro atomi di idrogeno ai vertici; i quattro legami C–H formano tra di loro quattro angoli di 109°,5.
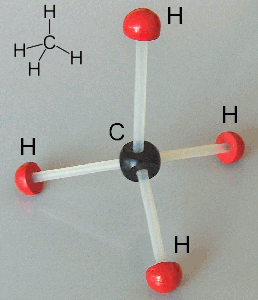
Stavolta l'orbitale s si "mescola" con tutti e tre gli orbitali p, dando vita per l'appunto a quattro orbitali sp3. che hanno la solita forma bilobata asimmetrica, e si trovano distribuiti nello spazio in modo da formare tra di loro angoli proprio di 109°,5. Ciascuno di questi quattro orbitali atomici forma un orbitale molecolare con i quattro orbitali 1s di altrettanti atomi di idrogeno, ed ecco generata la nostra molecola di metano!
Da notare che l'ibridizzazione degli orbitali, unendo fra di loro qualcosa che apparentemente sembrava incompatibile, ci ricorda che anche nella Terra di Mezzo avvennero dei "matrimoni misti". L'unione di Thingol e Melian è l'unica di cui si abbia notizia fra un Elfo ed una della stirpe dei Maiar, mentre si ha notizia di tre unioni tra Uomini ed Elfi: quella fra Beren e Lúthien, quella fra Tuor ed Idril Celebrindal (da cui nacque Eárendil) e quella fra Aragorn ed Arwen (ad esse si potrebbe aggiungere quella fra Eárendil ed Elwing, entrambi di sangue in parte umano ed in parte elfico). In due di questi casi (Lúthien ed Arwen) l'elfa scelse di rinunciare all'immortalità e di seguire il destino mortale del proprio sposo. Ecco invece quello che fu il destino di Tuor:
« In quel torno di tempo, Tuor sentì la vecchiaia addosso,
e costruì pertanto una nave che chiamò Earràme, cioè Ala Marina; e con Idril fece vela verso
l'ovest, né più se ne ebbe notizia in narrazioni o canti. Ma, in tempi successivi, si proclamò che Tuor, solo tra gli
Uomini mortali, fosse stato annoverato tra la razza Primogenita e che si fosse unito ai Noldor da lui tanto amati, essendo il suo fato scisso da quello degli Uomini. »
(QS, cap. XXIII)

L'Aufbau atomico non è però sufficiente, da solo, per interpretare quello che viene comunemente definito lo stato solido della materia. Nello stato solido le particelle costituenti la materia (molecole, atomi o ioni), a causa delle notevoli forze attrattive e repulsive che esercitano, sono costrette a rimanere localizzate in una struttura spaziale ben definita, detta la struttura cristallina. Di conseguenza, i solidi presentano una proprietà macroscopica caratteristica: sono rigidi e non comprimibili, possedendo volume e forma propria. Alcuni solidi, come il vetro o lo zolfo, derivano dalla rapidissima solidificazione di un fluido, e non presentano alcuna struttura cristallina; vengono perciò detti amorfi o falsi solidi. Il reticolo cristallino si ottiene ripetendo innumerevoli volte nello spazio una cella elementare senza lasciare spazi vuoti. Ad esempio, tagliando un cristallo di calcite (CaCO3) lungo piani determinati, i frammenti che si ottengono presentano la stessa forma del cristallo di origine, evidenziando a livello macroscopico l'esistenza della cella elementare.
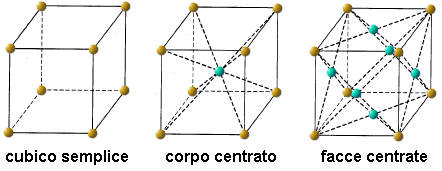
La scienza che studia la struttura spaziale dei cristalli prende il nome di cristallografia. Le possibili disposizioni di punti nello spazio per formare celle elementari di una struttura cristallina tridimensionale sono quattordici, e prendono il nome di reticoli di Bravais, dal francese Auguste Bravais (1811-1863) che per primo le descrisse nel 1848. I reticoli di Bravais si classificano in base alla forma della cella elementare, a ciascuna delle quali corrisponde uno dei sette sistemi cristallini: cubico, tetragonale, ortorombico, monoclino, triclino, esagonale e romboedrico. La struttura geometrica più comune è quella cubica, che a sua volta si può presentare in tre forme: cubica semplice; cubica a facce centrate; cubica a corpo centrato. Nel cristallo cubico semplice o sc (tipici esempi ne sono la pirite e il cloruro di sodio), le particelle si dispongono ai vertici di minuscoli cubi che si ripetono all'infinito. Nel cubico a corpo centrato o bcc vi è una particella anche al centro della cella cubica; tale struttura cristallina è tipica di molti metalli come gli alcalini, il bario, il cromo, il molibdeno e il tungsteno. Nel cubico a facce centrate o fcc vi è una particella anche al centro di ogni faccia, ed è comune in molti metalli come il magnesio, il calcio e il cobalto.
Varie sostanze, cristallizzando in condizioni differenti, possono dare vita a strutture cristalline diverse; questo fenomeno prende il nome di polimorfismo. Un esempio di polimorfismo è rappresentato dal carbonato di calcio (il già citato CaCO3), che si può presentare sotto forma di calcite, con struttura cristallina romboedrica, oppure di aragonite, con struttura rombica, con diversa durezza, densità e proprietà ottiche. Se è un elemento a presentarsi in più forme cristalline, si parla di allotropia, termine introdotto da Jöns Jacob Berzelius (1779-1848). Ad esempio, il ferro esiste in tre forme allotropiche, dette ferro alfa (a temperature inferiori a 910 °C) con un reticolo cubico a corpo centrato, ferro gamma (per temperature comprese tra 910 °C e 1394 °C) con un reticolo cubico a facce centrate, e ferro delta (per temperature comprese tra 1394 °C e 1538 °C), con un reticolo cubico a corpo centrato, più compatto di quello del ferro alfa. Anche lo zolfo esiste in due forme allotropiche, zolfo alfa (sotto i 96° C) con struttura ortorombica e zolfo beta (tra 96° e 119° C) con struttura monoclina. Celeberrime sono poi le tre forme allotropiche del carbonio: grafite (strati facilmente sfaldabili con i legami covalenti disposti a forma di esagoni regolari), diamante (cristalli tetraedrici) e fullerene (una struttura di 60 atomi di carbonio legati tra loro in una struttura chiusa formata da 20 esagoni e 12 pentagoni, come un pallone da calcio, scoperta nel 1985)
È possibile inoltre classificare i solidi in base al legame che si instaura tra le particelle che lo compongono:
solidi metallici (es. ferro), già discussi in precedenza. Sono duttili e malleabili, conducono calore e corrente elettrica, e presentano la tipica lucentezza metallica.
solidi ionici (es. cloruro di sodio), già discussi in precedenza. Sono molto duri e hanno alta temperatura di fusione. Conducono corrente elettrica solo allo stato solido.
solidi molecolari (es. ghiaccio). Questi solidi sono formati da molecole tenute assieme da forze intermolecolari, come il legame idrogeno, il legame dipolo-dipolo e la Forza di Van der Waals. Non sono conduttori e hanno bassa temperatura di fusione.
solidi covalenti (es. il diamante). In essi gli atomi sono legati tra di loro da legami covalenti che si ripetono nelle tre direzioni dello spazio. Sono durissimi, hanno temperatura di fusione molto alta (perchè il legame covalente è molto energetico) e non conducono corrente elettrica, essendo gli elettroni tutti trattenuti dentro i legami.
Vi è un classico esempio di solido covalente nell'universo fantasy creato da Tolkien: è l'archepietra, la più grande gemma mai scoperta dai Nani nella Montagna Solitaria, ad opera di Thráin I il Vecchio, antenato di Thorin e fondatore del Regno sotto la Montagna. Ecco come la descrive il nostro Professore:
« Era come un globo dalle mille facce; splendeva come argento alla luce del fuoco, come acqua al sole, come neve sotto le stelle e come la pioggia sopra la luna »
(Lo Hobbit, cap. XII)
Fu trovata da Bilbo durante la perlustrazione delle viscere della Montagna Solitaria e, dopo la Battaglia dei Cinque Eserciti nella quale Thorin trovò la morte, fu posta nella sua tomba scavata nelle profondità della Montagna, insieme alla sua spada Orcrist. Secondo alcuni fan di Tolkien (vedere ad esempio questo sito), l'archepietra avrebbe potuto essere addirittura uno dei tre mitologici Silmaril, i gioielli forgiati da Fëanor che portavano racchiusa al loro interno la luce dei Due Alberi! Infatti Maedhros, figlio di Fëanor, si era buttato con il suo Silmaril in una voragine ardente, e molto lentamente le forze tettoniche possono riportare il magma in superficie. L'archepietra è descritta più grande di un Silmaril, ma nelle viscere della terra la materia potrebbe essersi cristallizzata attorno al Silmaril, racchiudendolo al suo interno. Inoltre, sia il Silmaril che l'Archepietra brillavano di luce propria, uniche fra le gemme. Come si è visto in una precedente lezione, il Silmaril splendeva perchè in esso Fëanor aveva racchiuso il principio vitale degli Alberi, e una pietra, per quanto preziosa, formatasi nelle profondità del pianeta non avrebbe potuto racchiudere quel principio. Nonostante tutte queste coincidenze, però, l'identificazione dell'archepietra con uno dei Silmaril resta un'illazione, e Tolkien non vi fa mai cenno.
Se non si trattava di una gemma magica, cosa poteva essere l'archepietra? Indubbiamente un diamante. Queste pietre preziosissime e durissime hanno origine nel mantello della Terra, l'unico luogo dove esistono le condizioni di altissima pressione necessarie alla loro formazione. In particolare si pensa che i diamanti ritrovati in superficie provengano da una profondità compresa tra i 150 e i 250 km, trasportati nella crosta terrestre dentro una roccia detta kimberlite attraverso i condotti vulcanici, e questo non rende del tutto peregrina l'ipotesi del Silmaril riportato in superficie dalla lava. I Silmaril però andarono perduti alla Fine della Prima Era, cioè circa 5400 anni prima Thráin I la scoprisse; invece oggi si pensa che la maggior parte dei diamanti formatisi nel mantello e arrivati in superficie si siano formati tra un miliardo e mezzo ed un miliardo di anni fa. I tempi per l'identificazione perciò non tornano.
Quanto poteva essere grande l'archepietra? Possiamo paragonarla ad alcuni dei diamanti ritrovati nel "nostro" Universo. Il maggior diamante grezzo mai trovato al mondo è il Cullinan, detto anche Stella d'Africa, scoperto da Frederick Wells, direttore della Premier Mine in Sudafrica, il 26 gennaio 1905, e così chiamato in onore di Sir Thomas Cullinan (1862–1936), proprietario della miniera. Il suo peso era di 3.106,75 carati, pari a 621,35 grammi (un carato equivale a 0,2 grammi). Nel 1908 esso fu tagliato in ben 105 diamanti, di cui il più grosso è il Cullinan I, di 530,20 carati (106,04 grammi), che si trova incastonato nello scettro della Regina Elisabetta II d'Inghilterra, ed è conservato nella Torre di Londra. Si tratta del secondo più grande diamante tagliato al mondo; il maggiore è il Golden Jubilee, estratto nel 1985 dalla stessa miniera dove fu trovato il Cullinan, che raggiunge i 545,67 carati (109,13 grammi) ed oggi appartiene al Re di Thailandia. Tra i diamanti leggendari, uno dei più famosi è il cosiddetto Gran Mogol, appartenuto a Shah Jahan (1592-1666), l'imperatore dell'India famoso per aver costruito il Taj Mahal. Di colore blu chiaro, pesava non meno di 280 carati, e fu trafugato dall'imperatore persiano Nadir Shah (1688-1747) che saccheggiò l'India durante una campagna militare nel 1739. Nadir Shah fu assassinato nel 1747, e il diamante scomparve nel nulla. Si pensa sia stato tagliato in gemme più piccole; secondo alcuni il diamante Orlov da 189,62 carati (37,92 grammi), che si trova incastonato nello scettro dello Zar di tutte le Russie ed oggi è conservato nel Cremlino di Mosca, sarebbe derivato da esso.

Il diamante scoperto nella
miniera di Cullinan (a sinistra) a confronto con
l'archepietra (a destra), come è stata immaginata nei film di Peter Jackson
Possiamo farci un'idea dell'archepietra confrontandola con un diamante bianco da 232,08 carati (46,42 grammi), che la Petra Diamonds ha estratto nel settembre 2014 dalla prolifica miniera sudafricana da cui viene anche il Cullinan. Lo potete vedere qui sopra a sinistra; secondo gli esperti il suo valore potrebbe aggirarsi tra gli 8 e i 12 milioni di euro). Il Cullinan Heritage da 507 carati, trovato nella stessa miniera nel 2009, raggiunse addirittura il prezzo record di 35,3 milioni di dollari! È facile comprendere perchè Thorin riteneva tanto preziosa l'archepietra, da essere disposto a tutto pur di recuperarla!
Prima che me ne dimentichi, ecco la soluzione del quesito che vi ho proposto sopra circa la configurazione elettronica del ferro: [Ar] 4s2 3d6 e quella del flerovio: [Rn] 7s2 5f14 6d10 7p2. Se ci siete riusciti, mi complimento con voi, perchè avete assimilato perfettamente i contenuti di questa lezione!
Fino a qui abbiamo parlato di atomi, molecole e cristalli; ma sotto di essi, ancora più in profondità nel cuore della materia, vi sono altre particelle che i Fisici del Novecento hanno scoperto e studiato con grande pazienza, creando quello che oggi conosciamo con il nome di Modello Standard. Se volete procedere mano nella mano con me e con Tolkien all'esplorazione di esso, cliccate qui e seguitemi nel nostro ardito viaggio verso il mondo dell'infinitamente piccolo.
![]()