

Mediante trasnutazioni nucleari è possibile produrre un numero veramente alto di nuclidi. In totale, oggi se ne conoscono circa 3000, di cui 255 stabili e i restanti radioattivi. Solo 80 sono gli elementi che hanno almeno un isotopo stabile; 26 di essi sono monoisotopici, come l'alluminio, cioè hanno un isotopo stabile solo. Il record appartiene allo stagno, che ha la bellezza di 10 isotopi stabili! Di alcuni nuclidi si ignora ancora se siano stabili o primordiali a vita lunghissima; ad esempio, lo 134Xe, se è radioattivo, ha un'emivita certamente superiore ai 1030 anni. Ricordate la Tavola di Mendeleev, che raduna in bell'ordine tutti gli elementi chimici conosciuti? Appare lecito domandarsi se esiste una analoga tabella anche per i nuclidi, in modo da mettere ordine in uno "zoo" tanto affollato.. Ebbene, questa tabella esiste, e viene chiamata carta dei nuclidi. Poniamo in ascisse il numero Z dei protoni e in ordinate il numero N dei neutroni ( N = A – Z ). Disponiamo poi in questa tabella tutti i nuclidi stabili e quelli artificiali oggi conosciuti. Il risultato che si ottiene è questo:

I nuclidi con lo stesso numero Z di protoni sono disposti lungo linee rette orizzontali, e sono detti isotopi. Ad esempio, sulla retta di equazione Z = 30 ci sono tutti gli isotopi conosciuti dello zinco, che sono sette: 64Zn (48,6 % della miscela naturale, si ignora se sia stabile o primordiale; se è radioattivo, ha T1/2 > 1018 anni); 65Zn (radioattivo, T1/2 = 244,26 giorni); 66Zn (27,9 % della miscela naturale, è stabile); 67Zn (4,1 % della miscela naturale, è stabile); 68Zn (18,8 % della miscela naturale, è stabile); 70Zn (0,6 % della miscela naturale, si ignora se sia stabile o primordiale; se è radioattivo, ha T1/2 > 1016 anni); 72Zn (radioattivo, ha T1/2 = 46,5 ore).
I nuclidi con lo stesso numero N di neutroni sono disposti lungo linee rette verticali, e sono detti isotoni. Invece, i nuclidi con lo stesso numero di massa A sono detti isobari; siccome A = Z + N = cost., gli isobari sono caratterizzati dall'equazione N = – Z + A = – Z + cost., e dunque si trovano su linee rette inclinate verso il basso, che formano angoli di 45° con gli assi cartesiani.
I nuclidi stabili sono localizzati lungo una strettissima banda, detta comunemente valle di stabilità, mentre quelli radioattivi sono sparsi tutt'attorno. I nuclidi radioattivi al di sopra della valle di stabilità tendono a raggiungerla decadendo beta meno, in modo da aumentare il loro Z e a spostarsi verso destra nella carta; invece quelli al di sotto di essa tendono a decadere beta più, in modo da diminuire il loro Z e a spostarsi verso sinistra. Si osserva che, fino a circa Z = 20, i nuclidi stabili tendono a seguire la retta di equazione N = Z, cioè hanno più o meno tanti protoni quanti neutroni. Al di sopra di tale valore di Z, il rapporto Z / N è sempre minore di uno, e si fa sempre più piccolo al crescere di Z e di A. Ciò significa che nei primi nuclidi bastano tanti neutroni quanti protoni per contrastare la repulsione coulombiana mediante la forza nucleare forte,, mentre per Z più alti occorre un numero sempre maggiore di neutroni, giacché il nucleo diventa grosso e la forza nucleare ha un raggio d'azione molto ridotto.
Qui sotto vedete il primo frammento della carta dei nuclidi, per 0 < N < 14 e 0 < Z < 12 (il numero N dei neutroni qui è riportato in ascisse, e il numero Z dei protoni in ordinate). I nuclidi stabili sono colorati in azzurro; quelli che decadono beta meno sono colorati in arancione; quelli che decadono beta più sono colorati in verde.
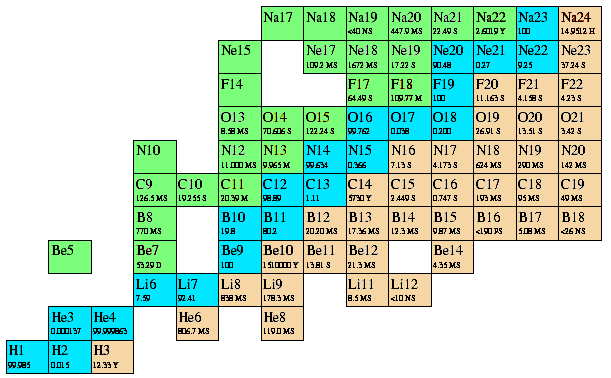
Al di là di Z = 82, nonostante la presenza dei neutroni, la repulsione coulombiana si fa tanto forte che non possono più esistere isotopi stabili. L'ultimo elemento con isotopi stabili è il piombo, dove vanno a concludersi tutte e tre le serie radioattive esistenti in natura. I transuranici addirittura hanno due volte più neutroni che protoni, ma nonostante ciò hanno solo isotopi instabili. Per valori di A molto grandi, i decadimenti beta più e beta meno lasciano il posto a decadimenti di tipo alfa, molto rari per Z piccoli, se si fa eccezione per 8Be, che tende a sfasciarsi in due particelle alfa (ma si tratta di un caso isolato).
Al crescere di A, diventa sempre più probabile che il nucleo si spezzi in altri due più o meno della stessa dimensione, cioè che subisca quella che viene chiamata una fissione spontanea. Essa è tipica dei transuranici (Z > 92) e in particolare degli elementi con Z > 109, chiamanti superpesanti. Questi nuclidi hanno tempo di dimezzamento sempre più breve: l'uranio-235 ha un T1/2 di 4,47 miliardi di anni; il plutonio-239 di 24.000 anni; il californio-249 (Z = 98) di 351 anni; il fermio-257 (Z = 100) di 100 giorni; il nobelio-255 (Z = 102) di 3 minuti; il bohrio-274 (Z = 107) di 54 secondi; il darmstadtio-281 (Z= 110) di 11 secondi; il flerovio-288 (Z = 114) di 0,8 secondi; il livermorio-293 (Z = 116) di appena 61 millisecondi; e l'oganessio-294 (Z = 118), uno dei nuclidi più pesanti oggi conosciuti, estremo avamposto della carta dei nuclidi verso l'ignoto, di soli 0,89 millisecondi! Appare evidente che, ad un certo punto, ulteriori isotopi avrebbero una vita media così corta, da disintegrarsi prima ancora di poter essere rilevati. Partendo da questa ipotesi, nel 1911 il chimico americano Elliot Quincy Adams (1888-1971) aveva previsto che non sarebbero potuti esistere elementi di massa atomica superiore a 256; come si è detto, la sua previsione si è rivelata troppo pessimistica, ma effettivamente i nuclei al di sopra di questa massa atomica hanno un tempo di dimezzamento così breve, che in chimica non possono avere alcuna utilità pratica. A sua volta il famoso Niels Bohr aveva previsto che non potrebbero esistere nuclei con numero atomico maggiore di 137, poiché il primo elettrone dell'orbitale 1s avrebbe dovuto viaggiare a velocità maggiore di quella della luce, ma la previsione ha poco senso perché il modello di Bohr è non relativistico, e non può essere applicato ad elementi i cui elettroni posseggono invece energie relativistiche. Usando invece l'equazione relativistica di Dirac si ottiene che l'energia di legame supera il proprio limite superiore per la prima volta nei nuclei con 173 protoni: per gli elementi più pesanti, se l'orbitale più interno non è riempito, il campo elettrico del nucleo spinge un elettrone al di fuori dell'atomo, determinando l'emissione spontanea di un positrone, ma questo non succede se l'orbitale più interno è riempito. Dunque l'elemento 173 non rappresenta necessariamente le Colonne d'Ercole della tavola periodica.
In ogni caso, nonostante la vita media così breve dei nuclei con massa atomica superiore a 256, alcuni chimici pensano che esistano delle "isole di stabilità" al di là di questo limite; in altre parole, configurazioni particolarmente stabili dei nucleoni nel nucleo farebbero sì che alcuni elementi esistano con vita media assai più lunga di quella attesa. Quest'ipotesi fu avanzata per la prima volta da Glenn Theodore Seaborg, lo scopritore del plutonio, in onore del quale è stato battezzato il seaborgio, l'elemento con Z = 106. Una prima isola di stabilità era attesa in corrispondenza della chiusura della shell nucleare con 114 protoni e 184 neutroni (uno dei cosiddetti nuclidi « doppi magici »). Si è cercato di produrre questo pesantissimo nuclide bombardando nuclei di plutonio-244 con nuclei di calcio-48, nella speranza che lo stato composto si liberasse di pochi nucleoni e restituisse un elemento stabile; nel marzo 1999 i ricercatori dell'Istituto di Ricerche Nucleari di Dubna (in Russia) hanno ottenuto con questa tecnica un nuovo elemento, poi battezzato Flerovio in onore del fisico russo Georgij Flërov (1913-1990); per la precisione, si trattava dell'isotopo 289Fl. Tale nuclide però non è affatto stabile, anche se effettivamente, essendo prossimo ad una struttura doppio magica, ha il tempo di dimezzamento più lungo tra tutti gli elementi artificiali con Z > 109: ben 2,6 secondi (alcuni però sostengono che potrebbe arrivare fino a 66 secondi). Il fisico russo Yuri Oganessian (1933-), al quale è stato intitolato l'oganessio, elemento con Z = 118, attorno a una massa atomica di 300 circa, e il fisico russo Yuri Oganessian (1933-), sostiene che dovrebbe esserci un'altra isola di stabilità intorno a Z = 164 (un valore davvero altissimo!), i cui elementi superpesanti avrebbero proprietà inimmaginabili, e spera di produrli facendo collidere due nuclei di uranio 238, così da originare un aggregato nucleonico terribilmente pesante ed instabile che, attraverso qualche canale di decadimento, porti ad uno di questi elementi. Finora, però, ogni tentativo è stato vano. Nell'universo di Star Trek si postula che nel 2371 d.C. alla Federazione Unita dei Pianeti saranno noti 246 elementi e, come narrato nell'episodio "Post Mortem", l'equipaggio della "Voyager" scoprirà il 247-esimo nel suo viaggio di ritorno a casa, un isotopo con un nucleo formato da ben 550 nucleoni, e dunque davvero "obeso". Se la previsione sarà azzeccata, non ci resta che armarci di pazienza, ed attendere la scoperta di quegli elementi davvero superpesanti, per i quali per ora invece non possiamo che ripetere i versi di Metastasio dedicati all'« Araba Fenice: che ci sia ciascun lo dice, dove sia nessun lo sa »...
