

Prendiamo in considerazione un nuclide: se esso emette radiazioni alfa o beta, si trasforma in un altro nucleo. Se questo è stabile, cioè se il suo tempo di dimezzamento è troppo lungo per essere misurato, prima o poi tutto l'isotopo di partenza si trasforma in questo, ma se esso a sua volta è radioattivo, si trasforma ulteriormente; questo può dare vita a un altro ancora, e così di seguito, fino a raggiungere finalmente un nucleo stabile. Questa catena di disintegrazioni prende il nome di serie radioattiva. La più nota di esse è quella dell'uranio, così detta perché parte dall'uranio-238 e arriva al piombo-206 (stabile) attraverso una successione di 14 decadimenti che può seguire tre diverse diramazioni, così sintetizzabili:
1) 238U
decade alfa in torio-234 con T1/2 = 4,468 miliardi di anni
2) 234Th decade beta meno in protoattinio-234 in 24,1 giorni
3) 234Pa decade beta meno in uranio-234 in 6,75 ore
4) 234U decade alfa in torio-230 in 245.500 anni
5) 230Th decade alfa in radio-226 in 75.380 anni
6) 226Ra decade alfa in radon-222 in 1622 anni
7) 222Rn decade alfa in polonio-218 in 3,824 giorni
8a) 218Po decade alfa in piombo-214 in 3,05 minuti
con una probabilità del 99,98 %, oppure
8b) 218Po decade beta meno in astato-218 con un probabilità
dello 0,02 %
9a) 214Pb decade beta meno in bismuto-214 in 26,8 minuti
9b) 218At decade alfa in bismuto-214 in 1,5 secondi
10a) 214Bi decade beta meno in polonio-214 in 19,8 minuti
con una probabilità del 99,98 %, oppure
10b) 214Bi decade alfa in tallio-210 con una probabilità
dello 0,02 %
11a) 214Po decade alfa in piombo-210 in 163,7
microsecondi
11b) 210Tl decade beta meno in piombo-210 in 1,3
minuti
12) 210Pb decade beta meno in bismuto-210 in 22,3 anni
13a) 210Bi decade beta meno in polonio-210 in 5,4 giorni
con una probabilità del 99,99987 %, oppure
13b) 210Bi decade alfa in tallio-206 con una probabilità
dello 0,00013 %
14a) 210Po decade alfa in piombo-206 in 138,4 giorni
14b) 206Tl decade beta meno in piombo-206 in 4,2
minuti
15) 206Pb è stabile.
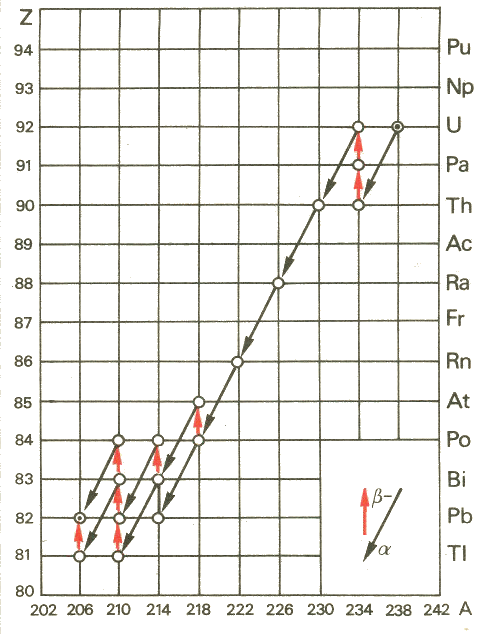
Notiamo che tutti i numeri di massa di questa catena differiscono di 4 l'uno dall'altro, partono da 238 ed arrivano a 206. Poichè tutti questi numeri possono essere espressi dalla formula ( 4 n + 2 ), con n opportuno numero intero > 50, tale serie viene chiamata anche serie ( 4 n + 2 ), nel senso che tutto gli isotopi con questi numeri di massa finiscono prima o poi per essere coinvolti in questa catena. Essa è una serie naturale, poiché nelle rocce in cui è presente l'uranio-238 si trovano effettivamente tutti questi nuclidi in equilibrio tra di loro, cioè in proporzioni definite. Un tempo questa serie era detta anche serie del radio, perchè fu grazie ad essa che Marie Curie scoprì tale elemento. Il radio-226 infatti ha un tempo di dimezzamento di "soli" 1622 anni, e quello creato al momento del Big Bang sarebbe già tutto disintegrato; la vita media relativamente "breve" fa sì che in natura se ne trovino solo tracce (da sette tonnellate di un minerale di uranio chiamato pechblenda, i coniugi Curie estrassero appena un grammo di radio!) Ma l'uranio-238, che ha un tempo di dimezzamento molto più lungo, esiste ancora e "rifornisce" la pechblenda del radio che noi troviamo in natura!
Si noti che per n = 61 si ha A = 4 x 61 + 2 = 246, numero di massa a cui corrisponde il curio-246 (246Cm), un elemento artificiale con Z = 96 che ha questo nome proprio in onore dei coniugi Curie. Ma esso decade alfa in 4730 anni in plutonio-242 (242Pu), che a sua volta decade alfa in 373.000 anni in uranio-238, e da qui in poi continua la catena dell'uranio fino al piombo-206! Curio e plutonio però in natura non si trovano, non esistendo alcun elemento loro progenitore a vita abbastanza lunga per sopravvivere dai tempi del Big Bang!
Esistono altre due serie naturali, che qui non illustreremo per esteso. La prima è la serie dell'attinio, così detta perchè tra i suoi anelli c'è l'attinio-231, la quale però parte da un altro isotopo dell'uranio, l'uranio-235, ed arriva fino al piombo-207. Tutti i suoi numeri di massa sono dati dalla formula ( 4 n + 3 ), con n > 50, per cui si parla anche di serie 4 n + 3. Le serie dell'uranio e dell'attinio contengono tutti e tre gli isotopi dell'uranio rintracciabili in natura: l'uranio-234 (0,005 % della miscela naturale), l'uranio-235 (0,72 %, ne riparleremo a proposito della fissione nucleare) e l'uranio-238 (99,275 %). Ma vi è un'ulteriore serie radioattiva, detta serie del torio, che parte dal torio-232 esistente in natura, ed arriva al piombo-208. I numeri di massa di tale serie sono tutti multipli di 4, per cui essa è detta anche serie 4 n, con n > 51. Tutte e tre queste serie si trovano in natura perchè il loro capostipite ha lunga vita, in modo da mostrare ancora oggi attività residua. E tutte e tre hanno termine quando si arriva ad uno dei tre isotopi stabili del piombo: piombo-206 (24,1 % della miscela naturale), piombo-207 (22,1 %) e piombo-208 (52,4 %).

A titolo di curiosità, vorrei aggiungere il fatto che il torio, scoperto nel 1815 dal chimico svedese Jöns Jakob Berzelius (1779-1848), fu da questi così battezzato nel 1828, in onore di Thor, il dio norreno del tuono. Il nome "Thor" deriva a sua volta dal proto-germanico *Thunraz, cioè "tuono" (in inglese "thunder", in tedesco "Donner", in olandese "donder", in danese e in norvegese "tonder", in antico svedese "tordön", in islandese "Þruma", in afrikaans "donderweer"): in inglese "Thursday" è "il giorno di Thor", corrispondente al nostro "giorno di Giove". In seguito il dio norreno fornì ispirazione a un celebre supereroe della Marvel (vedi la vignetta soprastante), le cui avventure furono pubblicate a partire dall'agosto 1962. Oggi tale supereroe è noto a tutti gli appassionati del genere fantasy perchè è diventato protagonista negli anni Duemiladieci di una fortunata serie di film d'azione, in cui l'eroe armato con il mitologico martello Mjöllnir ("Frantumatore") è interpretato dall'attore australiano Chris Hemsworth. L'associazione dell'elemento 90 al dio Thor e al suo corrispettivo fumettistico è diventata profetica dopo la scoperta della sua forte radioattività!
Sembra inevitabile, per quanto detto, che esista una quarta serie radioattiva, con numeri di massa ( 4 n + 1 ). Non vi sono altre possibilità, dato che ( 4 n + 4 ) equivale a 4 n, ( 4 n + 5 ) equivale a ( 4 n + 1 ), e così via; tutti i nuclidi conosciuti devono dunque rientrare in queste quattro serie. Il fatto è che la quarta serie non esiste in natura, perchè tutti i nuclidi con A = 4 n + 1 (209, 213, 217, 221...) hanno vita corta; essa giunge fino al tallio-205 (un tempo si diceva fino al bismuto-209, perchè tale isotopo era ritenuto stabile, mentre oggi sappiamo che anch'esso decade alfa, anche se la sua emivita è un miliardo di volte più lunga dell'attuale età dell'universo!). Si chiama serie del nettunio perchè il più longevo di tutti è il nettunio-237 (237Np), con T1/2 = 2,2 milioni di anni; una vita lunga su scala umana, non c'è dubbio, ma poca cosa se raffrontata ai 13,8 miliardi di anni della vita dell'universo. Invece, delle tre serie precedenti, i più longevi sono i capostipiti: T1/2 (235U) = 713 milioni di anni; T1/2 (238U) = 4,5 miliardi di anni e T1/2 (232Th) = 13,9 miliardi di anni. Come si vede, sono tutte comparabili con l'età dell'universo! Questi nuclidi vennero prodotti nel Big Bang, o comunque nelle prime fasi della vita dell'universo; il torio-232 da allora ha dimezzato la propria popolazione una sola volta, l'uranio-238 al massimo quattro volte, l'uranio-235 si è dimezzato 25 volte, il che significa che la sua popolazione si è ridotta a 30 miliardesimi del valore iniziale, ma in giro per l'universo ne resta comunque una quantità ancora apprezzabile. Invece il nettunio, come il plutonio, l'americio e tutti gli altri transuranici, hanno vita così breve, che la probabilità di sopravvivenza a partire dal Big Bang si è ridotta praticamente a zero. Ad esempio, il 237Np ha T1/2 = 2,2 x 106 anni, e dal Big Bang ad oggi si è dimezzato 10.000 volte. Ciò vuol dire che il numero iniziale dei suoi nuclidi si è ridotto di un fattore 210.000, cioè in pratica a zero! I nuclidi che, pur essendo stabili, sopravvivono in natura fino ad oggi dai tempi del Big Bang per via dei loro lunghi tempi di dimezzamento prendono il nome di nuclidi primordiali. Tali sono gli isotopi del torio e dell'uranio esistenti in natura, che hanno dato vita alle tre serie radioattive del torio, dell'attinio e dell'uranio. La serie del nettunio non esiste più perchè esso non comprende alcun nuclide primordiale.

|
Topolino, Pippo e Marie Curie nell'avventura a fumetti "Topolino e l'esperimento del Dottor Pi" pubblicata su "Topolino" n° 3175 del 28 Settembre 2016! |
In natura dunque esistono isotopi stabili, che non decadono mai (ad esempio il carbonio-12), isotopi instabili che si disintegrano in altri nuclidi attraverso decadimenti alfa, beta meno o beta più (ad esempio il carbonio-14) ed isotopi primordiali, come l'uranio-238, che vengono rinvenuti in natura perchè sopravvivono ancora dai tempi del Big Bang in cui vennero forgiati: applicando la formula del decadimento radioattivo, si trova che l'11,75 % dell'uranio-238 generato al momento del Big Bang esiste ancora. E così, finalmente abbiamo capito perchè i transuranici non esistono in natura: in realtà non esistono più in natura, essendosi già disintegrati tutti i loro nuclei prodotti al principio dell'universo. L'uranio è l'ultimo elemento della Tavola Periodica rintracciabile in natura perchè è l'ultimo dotato di una vita abbastanza lunga!
Naturalmente gli elementi fortemente radioattivi sono molto poco abbondanti sulla Terra, quindi è logico aspettarsi che il più radioattivo di tutti sia anche quello più raro. L'elemento che decade più rapidamente, tanto da sparire quasi subito, è il francio, scoperto nel 1939 dalla francese Marguerite Perey (1909-1975) e da lei intitolato alla sua patria: il suo isotopo più longevo, il francio-223, un tempo noto come ekacesio o attinio K (facendo parte della serie dell'attinio), ha un tempo di dimezzamento di soli 22 minuti. Ovviamente è raro, eppure non gli spetta il titolo di sostanza meno diffusa al mondo. Il pianeta Terra ha una massa di circa 6 x 1024 kg, cioè di seimila miliardi di miliardi di tonnellate, ma in essa si trovano non più di venti grammi di astato, che effettivamente è l'elemento più raro di tutti sulla Terra. Così scrive Sam Kean nel suo bestseller "Il cucchiaino scomparso":
« Per rendere più chiara la sua incommensurabile scarsità, immaginate di aver parcheggiato la vostra Lamborghini Astato in un colossale autosilo e di non ricordarvi più in quale punto la avete lasciata, Non c'è altra soluzione che passare in rasegna qui i piani e tutte le file, Ebbene, la ricerca dell'astato nella crosta tervestre equivale alla ricerca di un'uto in un parcheggio con cento milioni di piani, ognuno con cento milioni di fle, ognuna con cento milioni di posti. Ah, non è finita: l'autosilo non è unico, ma ce ne sono centosessanta identici, La vostra Lamborgini Astato è in uno a caso, da qualche parte. Decisamente vi conviene lasciarla li e tornare a piedi! »
L'astato, previsto da Mendeleev con il nome di ekaiodio, fu sintetizzato per la prima volta nel 1940 da Dale Raymond Corson (1914-2012), Kenneth MacKenzie (1912-2002) ed Emilio Segrè (1905-1989) nei laboratori dell'Università della California - Berkeley bombardando del bismuto con particelle alfa. Si tratta di un elemento primordiale, cioè quello presente all'inizio della vita dell'universo è già tutto decaduto da tempo, ma in alcuni casi questo elemento si ritrova come prodotto del decadimento nucleare di altri: se conosciamo la massa totale dei progenitori e calcoliamo la probabilità che un atomo di questi decada in astato, possiamo ricavare una misura plausibile della quantità totale dell'astato stesso. Allo steso modo, in base a questi calcoli in ogni momento esistono sulla Terra poco meno di trenta grammi di francio. Nessuno potrà mai raccoglierne un numero di atomi sufficienti a mettere insieme un campione visibile, e se un giorno ci riuscisse, la radioattività sarebbe cosi intensa da uccidere all'istante chiunque si trovasse nelle vicinanze (l'attuale record per un raggruppamento di atomi di francio è di soli diecimila). Eppure l'astato è molto meno radioattivo del francio: l'isotopo astato-210 ha un tempo di dimezzamento massimo di 8,1 ore, nonostante il suo nome derivi dal greco "àstatos", "instabile" (a differenza del francio ha una sua utilità: è un radioisotopo ad azione veloce che potrebbe essere utilizzato nella diagnostica medica, dato che si concentra nella tiroide). Il francio si trova a mezza strada fra l'elemento numero 82, il piombo, il cui nucleo corrisponde a un numero magico di nucleoni, e il numero 92, l'uranio, che è prossimo a un numero magico, dunque i suoi neutroni sono fortemente tentati di abbandonare la nave, e ciò fa del francio il più fragile tra tutti gli elementi con Z inferiore a quello dell'uranio. Eppure questo recordman dell'instabilità è meno raro dell'astato. Come mai ciò avviene? Il fatto è che molti elementi radioattivi situati dalle parti dell'uranio decadono in francio. Quest'ultimo però, invece di decadere a sua volta in astato emettendo una particella alfa, nel 99,9 % dei casi preferisce il decadimento beta, e diventa radio-223. Il radio a sua volta decade a catena emettendo particelle alfa, e "salta" l'astato. In altre parole, il decadimento di vari elementi radioattivi li porta a una breve sosta dalle parti del francio, mentre in genere saltano l'astato, che dunque è più raro. Sorpresi, vero?
|
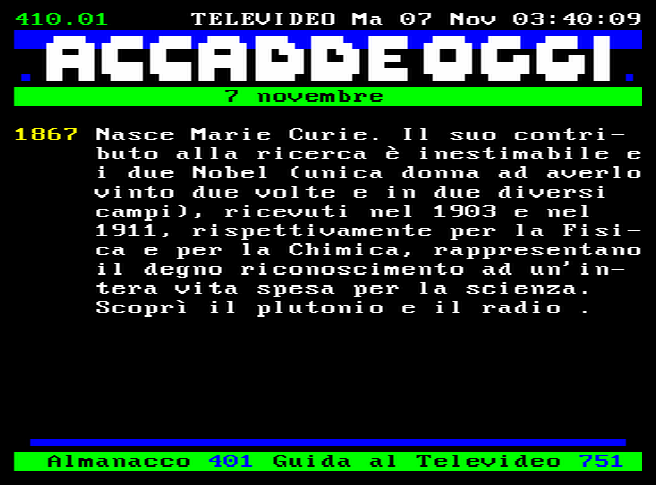
Il clamoroso errore comparso sulla sottopagina 1 della pagina 410 del Televideo Rai di martedì 7 novembre 2023: nell'Almanacco si ricorda l'anniversario della nascita della grande Marie Curie, ma le si attribuisce la scoperta di "plutonio e radio", mentre ella invece scoprì il polonio, così battezzato in onore della sua patria! Il plutonio invece fu sintetizzato nel 1940 da Glenn Seaborg ed Edwin McMillan nel ciclotrone del Lawrence Berkeley National Laboratory, presso l'Università di Berkeley in California! |