![]()
cliccate sulle immagini per ingrandirle
![]()
cliccate sulle immagini per ingrandirle

|
La chimica deriva il suo nome dal francese chimie, traduzione letterale di alchimia, a sua volta derivata dalla parola araba che indica la pietra filosofale, leggendario materiale che si diceva capace di tramutare i metalli in oro; proprio la vana ricerca di questa chimerica sostanza portò alla nascita della chimica come scienza. Ed ecco uno degli strumenti preferiti dagli alchimisti medioevali: il mortaio, usato per sminuzzare i componenti necessari per le loro manipolazioni! |

|
Nessun armadio, neppure uno Virtuale, contenente materiale per le esperienze di chimica, può fare a meno di contenere un'adeguata vetreria, versione moderna degli alambicchi e dei mortai (vedi foto precedente) tanto cari agli alchimisti dei secoli andati. Ecco un'ampia collezione di cilindri graduati e di becker delle più svariate capacità, da utilizzarsi per misurare e per miscelare i vari reagenti, come illustra meglio l'immagine sottostante. |

|
Come si vede, qui la vetreria è all'opera: in essa sono contenute diverse sostanze chimiche, alcune delle quali piuttosto pericolose, e per queste sono disposte su di un apposito ripiano in ceramica, protetto da antine di legno e vetro scorrevoli verso il basso; solo i tecnici di laboratorio possono maneggiarle. In tal modo i ragazzi possono assistere alle esperienze in tutta sicurezza. |

|
Ed ecco una tipica pinza da laboratorio, usata per afferrare beute piene di materiali pericolosi o crogioli nei quali sono stati fusi materiali ad alta temperatura. Ha un aspetto minaccioso, ma vi assicuro che è utilissima! |

|
Un'altra raccolta di materiale utile per esperienze di termodinamica, chimica ed elettrochimica è contenuta in questa raccolta di barattoli pieni dei più svariati composti chimici, tutti allo stato solido. Quello blu tipicamente è solfato di rame idrato (CuSO4 + 5 H2O), che useremo in successivi esperimenti. Alcuni barattoli hanno perso l'etichetta, e quindi andranno restaurati. |

|
In Laboratorio di Chimica, la maggior parte delle esperienze pericolose deve essere seguita sotto la protezione di un apposito ambiente con pareti di vetro, come si vede fare al nostro tecnico di laboratorio. Si noti (come mostra anche la foto seguente) che il tecnico indossa il camice di laboratorio, speciali guanti ed occhiali di protezione, nel timore che sostanze pericolose schizzino gli occhi. La stessa precauzione è adottata da tutti gli studenti in Laboratorio di Chimica. |

|
In un Armadio Virtuale di Chimica non può certo mancare una tavola periodica di Mendeleev, ideata dal chimico russo Dimitri Mendeleev (1834-1907) e modificata dal fisico danese Niels Bohr (1885-1962). Siccome altre sue versioni si trovano negli armadi di Elettromagnetismo e di Fisica Atomica, qui ho messo una foto di questa tavola scattata in una delle mie classi. Questa fu la prima classificazione razionale degli elementi chimici, e permise di prevedere l'esistenza di alcuni di essi. |
 |
La fotografia in questione è stata scattata in una farmacia, e dimostra che fino a non molti decenni fa i farmaci non eranno venduti inscatolati, ma realizzati dallo stesso farmacista pestando gli ingredienti in un mortaio, dietro prescrizione del medico. A volte gli ingredienti erano fantaiosi e poco raccomandabili, come la "polvere di mummia" (a cui un tempo si attribuivano proprietà medicamentose), ma è stato anche grazie agli esperimenti realizzati per produrre nuovi e più efficaci farmaci, che ha visto la luce la Chimica moderna! |

|
Quella che vedete qui e la Tabula Affinitatum, commissionata nel 1766 per la spezieria granducale di Firenze; oggi si trova al Museo Galileo di Firenze, dove è stata fotografata dalla mia allieva Sara Scampini (5 G a.s. 2011/12). Mostrando le affinità chimiche tra le diverse sostanze, essa precorre la tavola periodica di Mendeleev mostrata qui sopra, e doveva servire ad individuare i reagenti che meglio si combinavano tra di loro nel preparare prodotti farmaceutici. |

|
Alla base della Chimica c'è la distinzione tra composto e miscuglio. Nel primo i componenti hanno reagito dando vita a nuove specie chimiche, nel secondo invece sono uniti in una miscela eterogenea. Per separare i componenti di un miscuglio di questo tipo, basta immergerlo in un liquido in cui uno solo di essi è solubile. Ad es. la miscela di sabbia e sale da cucina in figura è facilmente separabile immergendo il tutto in acqua: la sabbia precipita sul fondo, il sale invece passa in soluzione. |

|
Come separare invece i componenti di una miscela solido-liquido? Una tecnica molto semplice è la filtrazione, che può essere realizzata mediante un imbuto a gambo lungo ed un filtro di carta; la parte solida della miscela eterogenea viene fermata dal filtro, mentre il fluido passa nel recipiente sottostante. In questa foto si vede il nostro tecnico di laboratorio intento a filtrare una miscela di acqua e polvere di rame, risultato di una reazione chimica. Il soluto viene trattenuto dal filtro grazie alla proprietà per cui le particelle con dimensioni maggiori dei pori della carta non riescono ad attraversarla. Di questo agevole procedimento è disponibile anche un breve filmato digitale. |

|
L'estrazione con solvente è un processo basato invece sulla solubilità di un composto. Se per esempio vogliamo separare due sostanze, delle quali una miscibile in acqua e l'altra in trielina, basta trattarle prima con l'una e poi con l'altra per ottenere il risultato desiderato (acqua e trielina non sono miscibili tra loro). Si noti però che l'estrazione con solvente è assai più familiare di quanto non crediamo, poiché la si applica tutte le volte che ci prepariamo del tè (vedi figura). L'acqua infatti è il solvente della teina, un alcaloide (C8H10N4O2) contenuto proprio nelle foglie del tè (Camellia sinensis) e nei semi di caffé. |

|
Ed ecco una semplice esperienza riguardante i liquidi immiscibili. Nella provetta sono stati posti mercurio, acqua e comune olio d'oliva; come si vede, i tre liquidi si stratificano senza miscelarsi. L'immiscibilità consegue dall'impossibilità di realizzare legami molecolari con energia minore di quella posseduta dai liquidi separati. Per esempio, le molecole dell'acido oleico (il costituente principale del normalissimo olio d'oliva, C18H34O2) sono rigorosamente idrofobe, a causa della struttura per nulla polarizzata. Se agitata, la miscela acqua-olio può dare origine ad una sospensione, ma mai a una soluzione. |

|
Un'esperienza davvero di grande impatto su gli studenti può essere eseguita ponendo in un cilindro graduato tre strati rispettivamente di acqua, olio ed alcool. Essendo immiscibili l'uno nell'altro, i tre fluidi si stratificano in quest'ordine dal basso verso l'alto, come mostra la figura. A questo punto si immerge nel cilindro un cubetto di ghiaccio, che va a collocarsi tra olio ed alcool, avendo peso specifico intermedio tra di essi. A poco a poco il ghiaccio si scioglierà rilasciando gocce d'acqua che, come mostra la foto sulla destra, affondano verso il basso, avendo l'acqua liquida peso specifico maggiore di quello dell'olio! Ringrazio molto la collega Chiara Brivio per avermi permesso di fotografare questa semplice ma efficacissima esperienza. |

|
La miscibilità è un fenomeno che dipende dalla temperatura; infatti, scaldando una miscela di acqua ed olio, ci si accorge che i legami molecolari tra di essi sono possibili, e che l'olio comincia a disciogliersi in acqua. Questo è il principio del comune brodo, come illustra questa fotografia in cui l'olio comincia effettivamente a sciogliersi non appena il fornello viene acceso e l'acqua comincia a scaldarsi. Chimica in cucina... |

|
La trielina o tricloroetilene (CHCl=CCl2) è un composto organico classificato come "alogenuro alchilico", ricavato dall'acido acetico (vedi più sotto), non infiammabile ed usato per smacchiare i tessuti. Quest'ultima sua proprietà le deriva dal fatto di essere un ottimo solvente per acidi grassi. Questo fatto è facilmente dimostrabile con una semplice esperienza che chiunque può eseguire nella propria cucina. Occorre una vaschetta (meglio se non di plastica) e del grasso animale. |

|
Per questa dimostrazione si è usato il grasso del prosciutto crudo. Se ne pone un frammento nella vaschetta e la si riempie di comune trielina. Dopo breve tempo il grasso si è completamente disciolto. Dunque i grassi, che non sono certo solubili in acqua, risultano solubili in altre sostanze come i composti alifatici, dei quali fanno parte i comuni idrocarburi. |

|
Si dice soluzione la miscela omogenea di due sostanze; quella presente in maggior quantità è detta solvente, l'altra invece soluto. Le particelle di soluto disciolto sono così piccole da risultare invisibili anche al microscopio. L'acqua è il solvente più comune, anche se si è visto che non tutte le sostanze sono solubili in acqua. Si dice concentrazione il rapporto tra la massa del soluto e il volume del solvente, e si misura in g/L. Nella foto si vede come preparare una soluzione di concentrazione nota: si pone in un becker graduato la quantità voluta di solvente e si pesa su una bilancia la quantità voluta di soluto. |

|
Se si supera il livello di solubilità di un soluto in un solvente, il primo precipita sul fondo del recipiente e non si discioglie più. Così, in questa fotografia si vede che, per quanto si rimescoli una miscela di acqua e cloruro di sodio, quest'ultimo continua a precipitare sul fondo (lo strato bianco che si vede sul fondo del becker). In genere la solubilità si esprime in termini di grammi per litro, ma può essere anche espressa in termini di molarità (moli di soluto per litro di soluzione). Tra i gas si ha sempre la completa miscibilità, ma per liquidi e solidi la solubilità dipende dalla temperatura, dalla pressione e dalla natura delle due sostanze: la solubilità di un gas in un liquido diminuisce al crescere della temperatura ed aumenta all'aumentare della pressione. |

|
Quello in figura è un agitatore magnetico, uno strumento indispensabile in un laboratorio di chimica, dove viene utilizzato per mescolare efficacemente un solvente e un soluto senza bisogno di cucchiai o agitatori esterni. Esso funziona mediante la rotazione di un’ancora sul fondo di un contenitore, sul quale agisce un campo magnetico rotante. La dimensione e la forma dell’ancora magnetica determinano l’efficacia dell’agitazione a parità di velocità di agitazione (quest'ultima è regolabile). Gli agitatori magnetici spesso sono anche dotati di riscaldamento per mezzo di una resistenza elettrica posta sotto il piano d'appoggio. Cliccando qui potete scaricare un filmato che lo mostra in azione.. |

|
L'acqua presente in natura normalmente contiene sostanze disciolte allo stato ionico (sali minerali), allo stato gassoso e in forma non ionica, oltre a composti di natura biologica. Questa fotografia di una fontana di Roma mostra proprio i sali minerali lentamente depositati dall'acqua sul travertino. Oggi le acque minerali sono state classificate come acque bicarbonate, acque carboniche, acque oligominerali, acque salse (cloruro-sodiche), acque salsobromoiodiche, acque solfate, acque sulfuree, acque radioattive, acque arsenicali ferruginose, eccetera. |
|
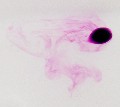
Questa foto illustra il fenomeno della diffusione, in base al quale un composto solubile immerso in un liquido a poco a poco si scioglie in quest'ultimo, dando vita a dei caratteristici vortici. In questo caso un cristallo di permanganato di potassio (KMnO4), spesso usato come disinfettante per uomini ed animali, si sta diffondendo nell'acqua dando vita ad una soluzione dal caratteristico colore violaceo. La diffusione è un fenomeno caotico descritto dalla cosiddetta equazione di Fick, una complessa equazione differenziale alle derivate parziali. |

|
Quello che si vede in figura è un affresco, una pittura eseguita cioè direttamente sull'intonaco fresco di una parete (" a fresco"). Solidificandosi, l'intonaco trattiene il colore che diventa così indelebile e resiste alle ingiurie del tempo (l'affresco in questione si trova nel santuario di S.Maria a Brunello, presso Varese, a me molto caro). Lo possiamo considerare un esempio di quello che in chimica si chiama adsorbimento, cioè l'adesione di sostanze disciolte in soluzione alla superficie di un corpo. |

|
La reazione di ossidazione avviene quando i metalli si combinano con l'ossigeno. Alcuni di essi, come lo zinco, si ricoprono di una patina coerente di ossido che impedisce l'ulteriore penetrazione dell'ossigeno e preserva il metallo sottostante. Invece il ferro, purtroppo, in ambiente umido dà vita ad un ossido incoerente chiamato comunemente ruggine per la sua rugosità; qui la vediamo su un'antica saracinesca scrostata. Il dissolvimento della ruggine scopre nuovo metallo, esponendolo all'azione dell' ossigeno; in tal modo, con il tempo, il ferro viene completamente attaccato e dissolto dall'ossidazione. |

|
Si chiama invece verderame la sottile patina verde, costituita da idrossocarbonati di rame, che ricopre questo metallo in seguito ad esposizione al biossido di carbonio contenuto nell'aria, come si vede su questa maniglia di un mobile di inizio '900. Può essere eliminato pulendo il rame con una mistura di aceto e sale, come insegnavano i "consigli della nonna". |
|
|
Si dice effervescenza il rapido sviluppo di un gas in un liquido, gas che risale rapidamente alla superficie. Il fenomeno può verificarsi come conseguenza del riscaldamento di una soluzione (la solubilità di un gas scende al crescere della temperatura), della diminuzione di pressione (la solubilità di un gas è direttamente proporzionale alla pressione) o, come in questo caso, di una reazione chimica. Nella foto si fa cadere succo di limone, cioè acido citrico (C6H8O7), su bicarbonato di sodio (NaHCO3), noto antiacido, e si ha il violento sviluppo di anidride carbonica che si libera in bolle. Ecco un breve filmato dell'esperimento. |

|
Tutti sappiamo che, se si prepara una tazza di tè, esso cambia colore se vi si spreme del succo di limone (a destra nella foto). Ciò significa che il colorante passato in soluzione dalle foglie di tè, in presenza dell'acido citrico contenuto nel limone, cambia colore. Aggiungendo del bicarbonato, che è una sostanza basica, si ripristina il colore originale dell'infusione. Questa semplicissima osservazione è alla base degli indicatori, sostanze capaci di cambiare colore in ambiente acido o basico, e quindi in grado di indicare l'acidità di una soluzione. Se ne riparlerà più avanti. |

|
La natura offre alcuni ottimi esempi di indicatori naturali. Uno di questi è l'ortensia, del quale parleremo meglio nell'Armadio Virtuale di Botanica, le cui infiorescenze hanno tipicamente un colore blu se il terreno è acido (cioè argilloso, ricco di torba o di stallatico), rosso se è basico (cioè calcareo). Si comporta cioè come un indicatore vivente di pH! In questa foto, da me scattata presso un giardino non lontano da casa mia, si vedono entrambi i colori l'uno accanto all'altro, appartenenti a piante diverse, il che indica differenze notevoli di acidità da punto a punto del terriccio dello stesso giardino! |

|
Ora descriveremo le fasi di una semplicissima esperienza da realizzarsi con materiale povero, cioè reperibile in tutte le case, e qui illustrato in questa fotografia. Occorrono delle comuni monetine da 1,2, 5 eurocent, un chiodo di acciaio ben pulito, un vasetto di vetro anch'esso pulito (quello del miele va benissimo), dell'aceto di vino bianco e del sale fine da cucina. Tutto questo ci aiuterà a realizzare in casa una semplicissima reazione chimica. |

|
Come si vede, bisogna porre le monetine (almeno una ventina) sul fondo del barattolo, già riempito con un bicchiere di aceto bianco nel quale è stato disciolto un pizzico di sale (il tutto va mescolato ben bene) Infine, sopra le monete si adagia il chiodo di metallo. Il tutto (la foto è stata ripresa dall'autore di questo sito in casa sua) va lasciato riposare per alcuni giorni. Dopo un po' di tempo che cosa si osserva? |

|
Ecco il risultato, sempre fotografato dal sottoscritto. Le monetine appaiono lucidissime, mentre il chiodo si è ricoperto di un sottile strato di rame (si osservi per es. la capocchia). Cosa è accaduto? Il rame delle monetine ha reagito con l'aceto (il sale fa da elettrolita), generando acetato di rame. Con il tempo quest'ultimo precipita sul fondo del barattolo e ricopre il chiodo. Un'esperienza semplicissima e suggestiva, che suggerisco a tutti di ripetere in casa loro. |

|
Quarta ed ultima foto dell'esperimento delle monete a bagno nell'aceto. Una volta estratte ed asciugate, le monete appaiono effettivamente come nuove di zecca, perché l'aceto ha fatto passare in soluzione lo strato superficiale di rame, assieme allo sporco e all'ossido che le ricopriva. Ma non meno spettacolare è il particolare sottostante del chiodo, che appare nettamente ricoperto di acetato di rame. La mano che compare in questa foto è quella di mia madre, prof.ssa Enrica Soldavini. |
 |
Come si evince dalla foto in questione, lo stesso procedimento (immersione in aceto) può essere usato per ripulire un vaso in rame o in ottone, come ho fatto in questo caso. Ma attenzione a non lasciare il pezzo di artigianato troppo a lungo a bagnomaria, altrimenti potrebbe risultare rovinato. L'acido acetico è un acido piuttosto debole: una soluzione 1 M in acqua a 20 °C (all'incirca la concentrazione dell'aceto in commercio per usi in cucina) ha pH pari a 2,4, e quindi solamente lo 0,4% delle molecole di acido acetico sono dissociate; ma pur sempre di un acido si tratta! |

|
Vediamo come realizzare un altro esperimento di chimica usando solo aceto (un acido molto facile da reperire!) e il guscio di un uovo. Come si osserva in alto a destra in questa figura, basta versare l'aceto in un bicchiere ed immergervi il guscio d'uovo, non importa se esso galleggia. Il guscio d'uovo è formato da calcare (cioè carbonato di calcio, CaCO3), lo stesso composto che costituisce il marmo, la dolomia ed il guscio dei molluschi. Ebbene, che cosa succede quando il carbonato di calcio entra a contatto con un acido, seppure non molto forte, come l'acido acetico? |

|
La risposta è illustrata in queste quattro fotografie, scattate in sequenza ad alcune ore l'una dall'altra: prima il guscio dell'uovo si ricopre di bollicine, poi si sposta e si solleva, quindi inizia a dissolversi all'interno del bicchiere d'aceto. La dissoluzione sarà completa dopo 48 ore, lasciando solo la membrana interna. La reazione tra CaCO3 ed acido acetico ha dato vita ad anidride carbonica (CO2), il gas che ha formato le bolle sul guscio d'uovo, ed acetato di calcio, solubile. Lo stesso risultato si otterrà ponendo in aceto un osso di pollo: dopo due settimane il calcio sarà stato distrutto, e dell'osso non rimarrà che la cartilagine! |

|
Nuova, divertente esperienza di chimica da realizzarsi con gli stessi "ingredienti" della precedente. Si prende un barattolo di vetro con coperchio, del tipo usato per i sottaceti, si pone all'interno di esso un uovo, stavolta intero, e poi si riempie il barattolo di aceto, chiudendolo con cura. Come nell'esperimento che precede, si osserverà che il guscio dell'uovo inizierà a dissolversi, e quindi ci si potrebbe aspettare che l'albume e il tuorlo dell'uovo si mescolino all'aceto contenuto nel nostro barattolo; ed invece... |

|
...invece, l'uovo resterà intero, ed anzi, come mostrano queste fotografie, inizierà a dilatarsi! Infatti la membrana interna dell'uovo, che protegge l'embrione dal mondo esterno, trattiene albume e tuorlo, mentre l'aceto progressivamente entra in esso per via del fenomeno dell'osmosi: se un setto poroso (in questo caso, la membrana) separa due soluzioni a diversa concentrazione, il solvente passerà spontaneamente attraverso il setto da quella più concentrata a quella meno concentrata. Se dopo una settimana si estrae l'uovo, si constata che esso è aumentato di volume, e che è divenuto elastico come una pallina di gomma! |

|
L'osmosi può essere verificata in laboratorio, anziché usando il materiale povero sopra descritto, utilizzando appositi sacchetti porosi colmi di diverse soluzioni, che vengono immersi in opportuni becker pieni d'acqua. Come si vede qui a sinistra, in un becker è stata posta una soluzione di acqua e lugol, e in esso è stato immerso un sacchetto poroso pieno di acqua e amido; nel secondo becker c'era una soluzione di acqua e amido, e il sacchetto conteneva acqua e lugol; il terzo becker contiene acqua e serve come confronto. Dopo un tempo che può variare da alcuni minuti ad alcune ore, il colore si è diffonde dal sacchetto al becker e viceversa, come dimostrano i tre recipienti ripresi nella fotografia qui accanto. |

|
Un'altra facile esperienza che può essere effettuata in tutte le scuole consiste nel realizzare una reazione di scambio semplice o di spostamento, cioè una reazione in cui un elemento libero reagisce con un composto e "sposta" uno degli elementi che compaiono in esso. Per realizzare quest'esperienza sciogliamo del solfato di rame idrato (CuSO4 + 5 H2O) in acqua, quindi immergiamo in essa una semplice pallina realizzata accartocciando un foglio di alluminio da cucina. |

|
Si noti che, per far sì che la pallina di alluminio affondi completamente nella soluzione, io l'ho avvolta attorno ad un comune sasso. Si lascia la pallina in immersione per un po' di tempo, e già dopo quattro ore ci si accorge che l'alluminio ha spostato il rame dalla soluzione; il rame rossiccio si deposita tutt'attorno alla pallina, mentre l'alluminio passa in soluzione, dando vita a solfato di alluminio secondo la reazione 2 Al + 3 CuSO4 --> 3 Cu + Al2(SO4)3. Spettacolare, vero? |

|
Dopo ventiquattr'ore, ecco lo spettacolare risultato: il rame è sparito dalla soluzione e si è depositato interamente sulla pallina di alluminio, mentre la soluzione è diventata lattiginosa a causa del prevalere in essa di solfato d'alluminio. Si noti che ho infilato nella soluzione anche una striscia di carta d'alluminio per alimenti, ed essa è così sottile che si è disciolta del tutto, sparendo completamente come una zolletta di zucchero disciolta nell'acqua. Un'esperienza facile ma di fortissimo impatto sugli allievi. |

|
Una delle reazioni chimiche più famose è quella di combustione, consistente nell'ossidazione di un combustibile con un comburente (generalmente l'ossigeno dell'aria), che avviene ad alta velocità e con notevole sviluppo di calore. Basta innescare la reazione, e poi essa procede fino all'esaurimento del combustibile o del comburente. Lo dimostra un comune focolare: basta accendere un po' di carta posta sotto il legno per far sì che questo bruci con fiamma viva e ad altissima temperatura. |

|
La reticella ha l'utilissima caratteristica di rompifiamma, illustrata da questa fotografia: ponendo un bruciatore ad alcool acceso sotto la reticella, la fiamma non riesce a superarla. Questo perchè le maglie della reticella sono strettissime ed impediscono il passaggio ad una quantità sufficiente di gas incandescenti per innescare la fiamma anche sopra la rete; se al contrario la fiamma è accesa sopra la rete, rimane al di sopra anche staccandola notevolmente dal Bunsen. Questa proprietà è particolarmente utilizzata per far bollire l'acqua nei becker di vetro senza rovinarli. |

|
Ed ecco un bell'esemplare di becco Bunsen, un bruciatore a gas che rende il nome da Robert Wilhelm Bunsen (1811-1899), il chimico tedesco al quale è erroneamente attribuita l'invenzione; in realtà il suo assistente di laboratorio Peter Desaga (1812-1879) perfezionò nel 1855 un progetto precedente di Michael Faraday. Il becco Bunsen brucia un flusso continuo di gas senza rischio che la fiamma abbia un ritorno nel tubo e giunga fino alla bombola. In genere il bruciatore usa gas naturale (metano, con piccole quantità di propano e butano); è composto da un basamento con il tubo da cui giunge il combustibile gassoso e quello da cui giunge l'ossigeno, e da un tubo verticale, all'imboccatura del quale viene acceso il gas. |

|
Un'esperienza semplicissima, insegnatami dal collega Fabrizio Morlotti, consiste nel far cadere alcune gocce di acido solforico o di acido cloridrico su di una normale zolletta di zucchero. Subito l'ambiente viene pervaso da odore di bruciato anche se non si è sviluppata alcuna fiamma. Questo perchè la reazione dell'acido sul glucosio provoca l'ossidazione di quest'ultimo anche in assenza di fiamma viva! L'esperienza non è affatto pericolosa ma risulta di notevole impatto sugli studenti. |

|
Si chiama disidratazione il processo per mezzo del quale si elimina l'acqua (di composizione o di cristallizzazione) da un composto chimico, e differisce dall'essiccazione, che è l'eliminazione dell'acqua di adsorbimento. La si può realizzare mantenendo la sostanza in un ambiente in cui la pressione parziale del vapor d'acqua sia minore della tensione di vapore della sostanza a quella temperatura. Ecco l'effetto della disidratazione su di un kiwi: si ritira e si raggrinza! |

|
Si chiama durezza dell'acqua la percentuale di sali minerali in essa disciolti. Essa si misura di solito in gradi francesi: un grado equivale a 10 milligrammi per litro di carbonato di calcio (non tutti lo sanno, ma il contenuto di calcio e ancor più di magnesio fa bene al cuore). Come si vede in figura, per misurare la durezza dell'acqua basta immergere in essa uno sticker opportunamente trattato (si trovano in commercio) e poi confrontarne il colore con un'opportuna scala cromatica. In Italia le regioni con l'acqua più dolce sono Friuli, Sardegna ed Umbria, quelle con l'acqua più dura sono Emilia-Romagna e Marche. |

|
Comincia con questa immagine una serie di fotografie che illustrano le strutture molecolari di varie sostanze. Naturalmente io non possiedo apparati tali da poter fotografare le molecole; ho fatto perciò ricorso a questo kit per la costruzione di formule di struttura bidimensionali. Gli atomi sono rappresentati da dischetti di plastica di colore diverso l'uno dall'altro, con tanti forellini quante sono le valenze; i legami si realizzano tramite molle incastrate nei forellini. Semplice ma divertente. Nota importante: io ho trovato questo materiale nel mio laboratorio e non so dare informazioni su dove acquistarlo! |

|
L'autore di questo sito si è sbizzarrito a costruire per gioco le molecole più svariate. Qui ne vediamo tre semplicissime. A destra, in nero, c'è una molecola di idrogeno (H2), mentre a sinistra sono costruite la molecola di ossigeno (O2) e quella di ozono (O3), quest'ultima formata da tre atomi di O e caratteristica dell'alta atmosfera. |

|
Ed ecco due basi: una debole, l'ammoniaca (NH3), che vedremo costruita anche più sotto in versione tridimensionale, ed una fortissima, l'idrossido di sodio o soda caustica (NaOH). Come si vede gli atomi di idrogeno sono rappresentati da dischi neri,m quelli di ossigeno da dischi bianchi, quelli di azoto da dischi azzurri, quelli di sodio da dischi gialli. Gli elementi del primo gruppo della tabella di Mendeleev (sodio, potassio, cesio, ecc...) sono chiamati proprio alcalini, cioè "generatori di basi"; si dice base (secondo la definizione di Brönsted) una sostanza capace di legare ad un acido degli ioni idrogeno. |

|
Un'altra base è rappresentata dall'idrossido di ammonio (NH4OH), in cui allo ione ammonio (NH4+) è legato un gruppo ossidrilico (OH-). Tutti gli idrossidi sono basi che contengono questo gruppo ossidrilico. |

|
I dischi rossi rappresentano il carbonio, che può essere bivalente o tetravalente (in questo caso è tetravalente). Se si lega a due atomi di ossigeno (dischi bianchi) si ha la comune anidride carbonica o biossido di carbonio (CO2), mentre se un atomo di ossigeno è sostituito da due gruppi ossidrilici si ha l'acido carbonico (H2CO3), che si dissocia facilmente in anidride carbonica ed acqua (è presente nelle comuni bevande gassate). |

|
Facendo reagire l'acido carbonico con ossido di calcio (CaO, la cosiddetta calce viva) si forma il carbonato di calcio (CaCO3, la cosiddetta calce spenta) che è alla base dei gusci dei gasteropodi e della tecnologia delle costruzioni edilizie. |

|
Il cloro (dischetto verde scuro) può avere valenza 1, 3, 5, 7 come tutti gli alogeni ("generatori di sali"), gli elementi del settimo gruppo della tavola periodica. Se ha valenza 1 (in basso) forma l'acido ipocloroso (HClO), mentre se ha valenza 3 (in alto) forma l'acido cloroso (HClO2). Con le altre due valenze si formano gli acidi clorico (HClO3) e perclorico (HClO4). Si noti che i buchi delle valenze inutilizzate vengono simbolicamente tappati con piccoli cunei di legno! |

|
Si dice acido una sostanza chimica in grado di rilasciare in acqua degli ioni idrogeno. Uno degli acidi più forti è quello solforico (H2SO4), del quale qui si vede la formula di struttura (l'atomo di zolfo è rappresentato dal dischetto marrone). È un liquodo viscoso, inodore e incolore, che si scioglie nell'acqua sviluppando moltissimo calore e si prepara nelle "camere a piombo". |

|
Ed ora, tre composti con i quali passiamo dalla chimica inorganica a quella organica (o chimica del carbonio). Se al metano (vedi più sotto) togliamo un idrogeno ed aggiungiamo un gruppo ossidrilico otteniamo l'acido metanoico o metanolo (formula CH3OH), assai pericoloso ma sfruttato da enologi senza scrupoli per l'adulterazione del vino. |

|
L'etano (C2H6) qui rappresentato è il secondo, dopo il metano, dei cosiddetti idrocarburi alifatici saturi o alcani, formati da una catena di atomi di carbonio legati fra loro, i cui legami restanti sono tutti saturati da atomi di idrogeno (la formula generale è CnHn+2). L'etano è un gas inodore che brucia con fiamma debolmente luminosa sopra i 1000° C. |

|
Se ad un atomo di idrogeno dell'etano se ne sostituisce uno di cloro con valenza 1, si ottiene il cloroetano (C2H5Cl); se gli atomi di cloro sostituiti sono due si ha il dicloroetano (C2H4Cl2), e così via. Il cloro è velenosissimo se inalato puro, ma nei composti diventa un componente fondamentale della chimica del carbonio (vedi anche più sotto). |

|
Un salto di qualità nella costruzione di formule di struttura può essere realizzato con questo kit che, utilizzando sferette dotate di buchi al posto dei dischi e bacchette rigide di plastica al posto delle molle, consente di realizzare strutture tridimensionali. Anche in questo caso ad ogni colore corrisponde un atomo di tipo diverso, anche se non è presente il simbolo dell'elemento: le sferette rosse sono gli atomi di idrogeno, quelle azzurre di ossigeno, quelle nere di carbonio, e così via. |

|
Come si vede, molti dei modellini di atomi sono già sagomati opportunamente per permettere l'incastro diretto tramite bacchettine di plastica cortissime. Lo studente in figura illustra i due modellini tridimensionali da lui realizzati di ammoniaca (NH3) a sinistra e di acqua (H2O) a destra. Tutti i modellini tridimensionali di questa rassegna sono stati costruiti con l'aiuto dei ragazzi della prima I a.s. 2005/2006, che si sono divertiti moltissimo durante un'ora di supplenza. |

|
La rassegna non può che cominciare con un composto chiamato in gergo tecnico ortossido di idrogeno, ma che non è altro che la comune acqua (H2O), mentre perossido di idrogeno è la nomenclatura esatta dell'acqua ossigenata (H2O2). Come si vede, i modellini possono essere realizzati a piacere con aste lunghe o corte. |

|
Ed ecco il biossido di carbonio o anidride carbonica (CO2), già realizzato con i modellini bidimensionali; come si vede, i legami carbonio-ossigeno ed ossigeno-carbonio formano tra loro un angolo di 180°, e l'atomo di carbonio (quello nero al centro) è stato sagomato opportunamente. Purtroppo il tipo di modellino ad aste corte è inadatto a rappresentare i legami multipli, proprio come nell'esempio che segue.. |

|
Questa è la molecola di acido nitrico (HNO3); realizzata solo con bacchette lunghe per illustrare il doppio legame N = O, mentre l'altro (più corto in figura) è di tipo dativo. Esso corrisponde allo stato di ossidazione + 5 dell'azoto (con + 3 si ha l'acido nitroso, HNO2), ed è no dei reagenti chimici più antichi, dato che lo usavano già gli Egizi per disciogliere l'argento; a partire dal XVII secolo lo si ottiene industrialmente per azione dell'acido solforico sul salnitro. Allo stato puro è un liquido incolore che fuma all'aria e tende a colorarsi di giallo in seguito alla formazione di ossidi d'azoto. |

|
L'idruro di azoto o ammoniaca (NH3) dà vita ad una curiosa molecola tridimensionale, simile ad un treppiede. I tre legani N-H formano tra loro angoli di 108°, perchè i nuclei di idrogeno si respingono tra loro, mentre la presenza nell'azoto di due elettroni un orbitale completo (2s) respinge a loro volta i tre legami, impedendo alla molecola di assumere una forma piana. |

|
Ancora più spettacolare la molecola di metano (CH4): l'orbitale 2s del carbonio ed i suoi tre orbitali 2p danno vita a quattro orbitali ibridi disposti in maniera assolutamente simmetrica nello spazio, il che dà vita ad una forma a tetraedro regolare con quattro legami C-H che formano tra loro angoli di 109°, derivati da un'ibridizzazione degli orbitali di tipo sp3. Come detto sopra, questo è il più semplice rappresentante della famiglia degli alcani. Davvero spettacolare, eh? |

|
Grazie a pezzi dotati di più fori, come quelli in figura, e ad opportune bacchette di metallo più sottili di quelle di plastica, è possibile costruire anche dei legami multipli. Si ha così la possibilità di costruire la formula di struttura dell'etilene o etene (C2H4), lun gas incolore di odore gradevole, con doppio legame C = C. Esso fa parte della categoria degli alcheni o olefine, composti con formula di struttura CnH2n e dotati di legami doppi tra gli atomi di carbonio, derivati da un'ibridizzazione degli orbitali di tipo sp2. Sono tutti sostanze poco polari, insolubili in acqua ma solubili nei composti organici. |

|
L'acetilene (C2H2) o etino è un idrocarburo alifatico insaturo fortemente esplosivo, contenente un legame triplo tra due atomi di carbonio; è un tipico rappresentante della famiglia degli alchini (CnH2n-2), con legami tripli tra gli atomi di carbonio che discendono da un'ibridizzazione degli orbitali di tipo sp. Anch'essi sono scarsamente polari e insolubili in acqua. |

|
Il cicloesano (C6H12) è un bell'esempio di cicloalcano, cioè di quegli alcani la cui catena carboniosa non termina con due idrogeni, ma è richiusa su sé stessa. Il cicloesano non ha un anello planare come quello del benzene, ma come si vede ha piuttosto la forma di una "seggiola" (può presentare anche la forma "a tino"): quattro atomi si trovano sullo stesso piano, uno al di sopra ed uno al di sotto. È un liquido incolore, insolubile in acqua ma solubilissimo nei solventi organici; lo si usa come solvente o come anello intermedio nella sintesi di molte sostanze organiche. |

|
Il cloroetano è già stato costruito poco sopra usando i modelli bidimensionali, ma ho voluto ricostruirne la formula di struttura usando anche quelli tridimensionali per mettere in evidenza le differenze tra le due rappresentazioni (qui l'atomo di cloro è quello verde di notevoli dimensioni). È un classico esempio di gruppo funzionale, un raggruppamento di atomi legati ad una catena carboniosa che entra tutto intero in una reazione chimica. se il gruppo funzionale è un alogeno e la catena carboniosa è un alchilico (derivato cioè dagli alcani) si parla di alogenuro alchilico. In questo caso CH3-CH2- è il gruppo alchilico derivato dall'etano, e l'alogeno è il cloro. Gli alogenuri alchilici reagiscono facilmente realizzando reazioni di sostituzione. |

|
Si dicono alcoli i composti che si ottengono sostituendo un idrogeno degli idrocarburi saturi con il gruppo ossidrilico -OH. Si distinguono in primari, secondari o terziari a seconda che il carbonio legato all'ossidrile sia a sua volta legato ad uno, a due o a tre atomi di carbonio. Sono composti polari, a differenza degli idrocarburi (si ricordi l'esperienza con la buretta), e sono solubili in acqua per la formazione di ponti idrogeno, che spiegano anche l'alta temperatura di ebollizione. Il primo della serie è l'alcool metilico o metanolo (CH3OH), del quale si è già parlato sopra. |

|
Il secondo alcool della serie è l'alcool etilico o etanolo, derivato dall'etano e quindi con formula bruta CH3CH2OH. Lo si prepara per fermentazione dei carboidrati, ed è il costituente fondamentale delle cosiddette bevande alcoliche (vino, birra, liquori, ecc.) L'alcool etilico detto denaturato non è potabile perchè, per riconoscerlo, gli è mescolato un colorante (invece l'etanolo puro è incolore), oltre a sostanze tossiche difficili da separare; lo si usa in campo industriale o per le pulizie della casa. |

|
Esistono anche alcoli con due o più gruppi ossidrilici, legati a diversi atomi di carbonio. Un esempio è fornito dal glicol-etilenico in figura, detto anche 2-etandiolo (CH2OH-CH2OH), tipicamente adoperato come anticongelante nei radiatori delle automobili. |

|
Un alcool con più gruppi ossidrilici è la glicerina o 1.2.3-propantriolo (CH2OH-CHOH-CH2OH), un liquido denso e solubile in acqua che bolle a 290°. Essa è famosa perchè è uno dei costituenti fondamentali delle creme idratanti per viso e mani e per molti cosmetici. Se reagisce con tre molecole di acido nitrico, essa dà origine alla famigerata trinitroglicerina (C3H5N3O9), un composto estremamente instabile: se urtato violentemente, dà luogo a una esplosione violentissima. Facendola assorbire da farina fossile si ottiene un esplosivo meno pericoloso, la dinamite, ideata dall'italiano Ascanio Sobrero. |

|
Ed ecco un esempio di acido formico (HCOOH), il primo degli acidi organici carbossilici, cosiddetti perchè formati levando un gruppo CH2- ad un alcano e sostituendolo con un gruppo carbossilico -COOH. Come si vede, l'acido formico deriva dal metano e quindi viene chiamato anche acido metanoico. È un liquido incolore, caustico e tossico, di odore pungente, che deriva il suo nome dal fatto di essere inoculato come veleno dalle formiche; lo si trova però anche nelle ortiche e nelle foglie aghiformi degli abeti. I suoi sali, detti formiati, vengono usati nell'industria farmaceutica. |

|
Il secondo degli acidi organici carbossilici è l'acido acetico o etanoico (CH3COOH), cosiddetto perchè deriva dall'etano ma lo si trova nel comune aceto di vino. Sicuramente è il più importante e il più impiegato di tutti gli acidi organici; è un liquido incolore dal caratteristico odore pungente, prodotto industrialmente per ossidazione catalitica con aria dell'aldeide acetica liquida, in presenza di acetati come catalizzatori. Lo si produce però anche nell'ossidazione di idrocarburi gassosi e nella fermentazione ossidativa dell'alcool etilico per opera del microrganismo Mycoderma aceti, metodo ben noto agli enologi. |

|
Si dicono eteri i composti in cui un atomo di ossigeno fa da ponte tra due gruppi alchilici. Non formano legami idrogeno, e quindi bollono a temperatura inferiore rispetto agli alcoli; sono però solubili in acqua. In figura si vede la formula di struttura tridimensionale dell'etere dimetilico o dimetil-etere (CH3-O-CH3), il più semplice della serie. |

|
Le aldeidi sono composti organici caratterizzati dal gruppo carbonilico =C=O legato ad un idrogeno e ad un gruppo alchilico. Qui vediamo la formula di struttura dell'etanale o acetaldeide (CH3CHO), che si presenta come un liquido incolore di odore pungente, ottenuto deidrogenando l'alcool etilico a 300° C usando il cromo come catalizzatore. Esso dà vita facilmente a polimeri detti resine acetaliche, di tipo termoplastico ed oggi assai usate. |

|
Se il gruppo carbonilico è legato a due gruppi alchilici si forma un chetone, come ad esempio l'acetone (o dimetilchetone o propanone) illustrato nella foto, con formula CH3COCH3. Si tratta di un liquido incolore e volatile, infiammabile e dall'odore gradevole, solubile sia in acqua che in alcool e in etere; nel metabolismo umano è un prodotto del metabolismo dei grassi. È altresì usato come solvente nell'industria delle fibre tessili e delle vernici. |

|
Il butadiene (C4H6) in figura è il termine più semplice della serie dei dieni, idrocarburi alifatici contenenti due doppi legami. La sua importanza è legata alla possibilità di fornire polimeri: la prima gomma sintetica fu realizzata nel 1939 con un processo di polimerizzazione per addizione, partendo come monomero dal butadiene. Il modello in figura è stato costruito con perizia dall'allievo Thomas Mai (V C ginnasio 2005/06) durante un'ora di supplenza. |

|
Il famigerato benzene (C6H6) di cui qui è rappresentata la formula di struttura, è un composto aromatico (i cui elettroni sono cioè delocalizzati lungo tutto l'anello chiuso); benché cancerogeno, è emesso normalmente dai tubi di scappamento di tutte le nostre automobili. È un composto aromatico di tipo ciclico, caratterizzato cioè da una catena chiusa di atomi di carbonio.. |

|
I fenoli sono composti con uno o più gruppi ossidrilici direttamente legati all'anello del benzene. Per la presenza di legami idrogeno, hanno alta temperatura di ebollizione e sono in generale più acidi degli alcoli. Se reagiscono con le basi danno vita ai fenati. Il composto più semplice della serie è appunto conosciuto come fenolo (C6H5OH). Esso viene fatto reagire con la formaldeide per dare vita a resine fenoliche come la bachelite, oggi usatissima. |

|
Ed ecco il nitrobenzene (C6H5NO2), ottenuto per nitrazione del benzene. Risulta assai tossico sia per ingestione che per inalazione, e lo si utilizza per ottenere l'anilina come prodotto di reazione totale in soluzione acida. Oggi sappiamo che gli elettroni dei carbonii sono delocalizzati lungo tutta la catena atomica (è tipico delle sostanze aromatiche). |

|
Si dicono esteri i composti organici prodotti dalla reazione di un alcole o di un fenolo con acido carbossilico o un suo derivato. La loro caratteristica è quella di contenere un gruppo CO=O che collega due parti della molecola. Ci sono anche esteri inorganici, ottenuti da reazione degli alcoli con acidi inorganici, che hanno proprietà simili ma struttura leggermente diversa. Gli esteri a basso peso molecolare hanno odore gradevole, mentre gli altri sono inodori. Esteri naturali di elevato peso molecolare sono i grassi e le cere. In figura vediamo la struttura dell'estere metilico dell'acido formico (C2O2H4). |

|
Ed ecco a voi la molecola di acido acetilsalicilico (C9H8O4), un estere dell'acido salicilico con acido acetico (è presente infatti il gruppo OCOCH3), noto con il nome registrato di aspirina. Si tratta di uno dei farmaci di uso più comune nel mondo, derivato dagli infusi di corteccia di salice (donde il nome) realizzati dagli indiani d'America per lenire i dolori. La salicina fu ricavata per bollitura della corteccia di salice da Johann Andreas Buchner nel 1828, mentre l'acido salicilico puro fu ottenuto dall'italiano Raffaele Piria nel 1838. La registrazione del marchio Aspirina in Germania risale al 1899 con Adolf von Bayer. |

|
Ed eccoci agli gli amminoacidi, delle molecole organiche che nella loro struttura recano sia il gruppo funzionale dell'ammina (-NH2) sia quello dell'acido carbossilico (-COOH). Gli amminoacidi sono gli elementi costitutivi delle proteine. Infatti, per eliminazione di una molecola di acqua, il gruppo amminico di un amminoacido può legarsi al gruppo carbossilico di un altro formando un legame peptidico. Una catena di più amminoacidi legati attraverso legami peptidici costituisce una proteina. Qui vediamo la molecola di alanina (C3H7NO2), che può venire prodotta nei muscoli umani a partire dall'acido glutammico. |

|
Ed ecco invece un altro amminoacido, la cisteina (C3H7NO2S); anch'essa può essere sintetizzata dal corpo umano a partire dalla metionina. Nei bambini e durante lo sviluppo, in caso di carenza di vitamina B, se ne raccomanda invece l'assunzione mediante la dieta, in quanto questa trasformazione è inibita o meno efficiente. La cisteina è indispensabile per il processo di cheratinizzazione, ed è presente in grandi quantità nello strato esterno della cuticola del pelo: un'alimentazione priva o povera solo di cisteina determina una netta diminuzione nella produzione di peli. |

|
Passiamo ora alla lisina (C6H14N2O2), resa famosa dal romanzo "Jurassic Park", perchè ai dinosauri di Michael Chrichton era stato inibito geneticamente di produrla. Anche nel nostro caso va assunta tramite l'alimentazione, dato che l'organismo umano non è in grado di sintetizzarla. Essa è presente soprattutto nella carne (carne rossa, maiale, pollame), nel formaggio, in alcuni pesci (merluzzo e sardine), nella soia e nei suoi derivati; è invece scarsamente presente nei cereali. Una carenza di lisina può portare ad una carenza di vitamina B3, e quindi alla pellagra. |

|
Questa invece è la serina (C3H7NO3), altro amminoacido che l'organismo umano è in grado di sintetizzare. Il suo gruppo laterale può subire una reazione che comporta l'addizione di una molecola di glucosio; questo la coinvolge nella catena di reazioni biochimiche che spiegano alcuni gravi effetti del diabete. In natura sono stati finora scoperti oltre 500 amminoacidi diversi, ma quelli che compaiono nelle proteine di tutti gli organismi viventi sono 20 e sono sotto il controllo genetico, cioè l'informazione circa il tipo e la posizione di un amminoacido in una proteina è codificata nel DNA. Alcuni di essi sono detti essenziali, in quanto non possono essere sintetizzati dal nostro organismo, ma devono essere assunti con il cibo. |

|
Chiudiamo la rassegna con la molecola di fenilalanina (C9H11NO2), uno degli amminoacidi essenziali per l'uomo (gli altri sono l'isoleucina, la leucina, la lisina, la metionina, la treonina, il triptofano, la valina, e, nei bambini, l'arginina e l'istidina); il suo gruppo laterale è un gruppo benzile. La fenilalanina si trova nel formaggio, nell'avocado, nelle banane, nelle mandorle e nei semi di zucca gialla. Entra inoltre a far parte della composizione dell'aspartame, un dolcificante chimico molto comune. |

|
Questa fotografia illustra come è possibile spiegare il funzionamento di una reazione chimica utilizzando i modellini 3-D testé descritti. Si tratta di una reazione di neutralizzazione, in cui acido cloridrico (HCl) e idrossido di sodio (NaOH) reagiscono per dare un sale, cloruro di sodio (NaCl), e acqua. Basta smontare le molecole a sinistra per riottenere quelle a destra! |

|
Quello qui ritratto sulla sinistra è un serbatoio di ossigeno liquido usato per scopi ospedalieri; a destra vediamo invece il dispositivo che permette di distribuirlo ai pazienti nelle loro camere, dopo averlo addizionato con vapore acqueo. L'ossigeno è l'elemento chimico più comune nella crosta terrestre (ne rappresenta circa il 47 % della massa) e il secondo più comune nell'atmosfera (il 21 %); è essenziale per la respirazione (per questo viene utilizzato in medicina), ma serve anche nella saldatura, nella produzione di acciaio e metanolo e come combustibile per razzi. |
 |
Ed ecco un misuratore della concentrazione di anidride carbonica in aria in parti per milione, utilizzato in una delle aule della mia scuola per indicare quando è necessario aerare gli ambienti: in un'aula infatti la concentrazione di CO2 non dovrebbe mai superare le 1400 parti per milione. Come di vede, il misuratore segna 1485 ppm, e si è messo a lampeggiare e ad emettere un segnale acustico, indicando la necessità di aprire le finestre per arieggiare l'ambiente! |

|
La fotografia rappresenta un serbatoio di acido cloridrico fotografato nei pressi di un laboratorio, con segnali di pericolo ben in evidenza. La formula, semplicissima, è HCl, ed è rappresentata nell'angolo in basso a sinistra; il nome scientifico esatto è cloruro di idrogeno, e rappresenta certamente il più importante composto del cloro. Lo si trova in commercio in soluzione acquosa al 40 % in peso con il nome commerciale di acido muriatico; è presente anche nei succhi gastrici per la demolizione del cibo. È un acido fortissimo che reagisce con tutti i metalli (con alcuni, come il molibdeno, solo a caldo, e con il rame solo in presenza di ossigeno). Risulta terribilmente corrosiva per i tessuti umani, e soprattutto per gli occhi! |

|
Ed ecco due composti chimici molto usati in laboratorio, qui presentati in soluzione acquosa: ioduro di sodio (NaI) e nitrato di piombo, di formula Pb(NO3)2. A temperatura ambiente il nitrato di piombo si presenta come un solido bianco inodore, molto solubile; è un composto tossico, nocivo per la riproduzione, pericoloso per l'ambiente. Invece lo ioduro di sodio deriva dall'acido iodidrico (HI); a temperatura ambiente si presenta come un solido incolore e inodore. |

|
Quello illustrato in fotografia è un "pezzo da museo": un pezzo di sapone risalente addirittura agli anni quaranta del secolo scorso, eppure ancora perfettamente utilizzabile. Il sapone è costituito dai sali degli acidi carbossilici a catena lunga (anche 18 atomi). La loro azione detergente si spiega in questo modo: essi hanno un'estremità polare idrofila ed una apolare lipofila (cioè attirata dai grassi). Una volta in acqua, essi orientano l'estremità polare verso le molecole d'acqua e quella apolare verso le molecole di grasso, che vengono così circondate da un aggregato in grado di essere lavato via dall'acqua corrente. |

|
Passiamo ad una candela stearica (precisamente una di quelle usate a Lourdes nella processione serale): si tratta di una candela realizzata non con cera d'api, ma con stearina, un trigliceride derivato dalla condensazione di tre molecole di acido stearico (formula CH3(CH2)16COOH) con il glicerolo. A differenza della paraffina, che proviene dal petrolio, la stearina viene ricavato dall'olio di palma. Le candele steariche furono ideate nel 1818 e perfezionate in seguito Antonio Meucci, inventore anche del telefono. |

|
Quest'immagine ci trasporta nel mondo dei polimeri, sostanze organiche le cui molecole, di enormi dimensioni, sono ottenute dalla ripetizione di piccole unità legate con legami covalenti; il processo di produzione di queste molecole, fondamentale nella moderna ingegneria chimica, prende il nome di polimerizzazione. Quello in figura è il comune polistirolo, solido amorfo ottenuto dalla polimerizzazione dello stirene (C6H5-CH=CH2), sostanza aromatica oleosa; il corrispondente polimero è invece una sostanza spugnosa ed estremamente leggera, molto usata negli imballaggi ma molto inquinante se dispersa nell'ambiente. |

|
La foto in questione ci permette di parlare della solanina, un glicoalcaloide tossico presente nelle solanacee ed in particolare nelle patate, nei pomodori e nelle melanzane. L'ingestione di elevate quantità di solanina provoca sonnolenza, mal di testa e diarrea; in dosi molto elevate può risultare addirittura mortale. Nelle patate la solanina si concentra soprattutto su bucce e germogli. Ma allora perchè noi consumiamo patate in così grande quantità? Perchè per rendere inoffensiva la solanina basta sottoporle a cottura. Anche la conservazione in un luogo asciutto e buio limita la formazione di questo alcaloide. |

|
Un fenomeno assai noto è quello in base al quale cipolle e i porri, se tagliuzzati, fanno piangere (le mani sono di mia mamma). Il fatto è che i tessuti lacerati rilasciano un enzima che induce la formazione di acidi sulfenici, i quali sono volatili, e quindi responsabili del caratteristico odore; ma nella parte anteriore della cornea dei nostri occhi sono presenti terminazioni nervose che rilevano tali sostanze irritanti, e sollecitano il nervo ciliare, che invia messaggi di dolore sotto forma di una sensazione di bruciore provocata da un'irritazione dell'occhio, che in realtà non si verifica, e invia comunque segnali alle ghiandole lacrimali, provocando così un'abbondante lacrimazione in grado di lavare le presunte sostanze irritanti. Cuocendo i porri come in figura, tuttavia, le sostanze urticanti si decompongono e la sensazione di fastidio cessa! |

|
Dell'acido nucleico noto come DNA riparleremo nell'Armadio Virtuale dedicato alla vita, tuttavia qui non posso esimersi dall'inserire delle foto di modellini della doppia elica del DNA, costruiti dagli studenti del mio Liceo. Il DNA fu isolato per la prima volta nel 1869 dal biochimico svizzero Friedrich Miescher, che lo individuò nel pus di bende chirurgiche usate, ma la sua forma e la sua funzione di depositario dei caratteri genetici dell'individuo vennero scoperte solo nel 1953 dalla chimica inglese Rosalind Franklin (1920-1958), anche se il merito della scoperta le fu scippato da James Watson e Francis Crick. |

|
L'immagine in questione raffigura due burette, una contenente acqua, l'altra esano, utilizzate per osservare il fenomeno di deflessione dell'acqua. In altre parole, avvicinando una bacchetta elettrizzata al flusso d'acqua si osserva una deviazione dovuta alla polarità delle molecole d'acqua, mentre l'esano, la cui molecola è tipicamente apolare, non devia. Un'esperienza semplice eppure didatticamente interessantissima, per il contributo della quale ringrazio anche la gentile collega Raffaella Calbucci, che ha fornito il permesso alla pubblicazione di questa ed altre foto. |

|
In questa foto sul bancone da laboratorio sono allineati gli strumenti e i composti necessari per eseguire alcuni istruttivi saggi alla fiamma. In pratica si raccolgono piccole quantità di sostanze varie (in questo caso tutti nitrati) mediante un'ansa di platino, resistente al calore, dopo aver purificato quest'ultima in acido cloridrico 6 M per eliminare eventuali residui, e le si espone alla parte più esterna della fiamma, che è più calda essendo a contatto con l'ossigeno. |

|
Le fotografie di quest'immagine composita sono invece dovute a Martino Sorbaro (I A cl. a.s. 2005/2006), e mostrano l'esecuzione dei saggi alla fiamma di cui si è visto allineato il materiale nella foto precedente. Si osserva che ogni sostanza dà fiamme di colore diverso dalle altre, dimostrando che l'energia emessa dagli atomi eccitati dipende dalla struttura elettronica degli stessi (vedi anche la galleria di Fisica Atomica). |

|
L'immagine ritrae un'esperienza davvero divertente: alcune spiraline di rame sono immerse in acetato d'argento. Ben presto le spiraline di ricoprono di minuti cristalli d'argento, che poi possono essere raccolti ripulendo il tutto con acetone. In tal modo gli studenti si improvvisano... cercatori di metalli preziosi! |

|
Ed ecco una cartina al tornasole, cioè una striscia di carta imbevuta di una soluzione ricavata da alcuni licheni e formata da diverse sostanze coloranti, la principale delle quali è l'azolitmina. Essa ha la proprietà di colorarsi di azzurro in ambiente alcalino e di rosso in ambiente acido. È ciò che accade nella fotografia, mettendola a contatto con semplice succo di limone. |

|
Un altro indicatore molto utile in chimica è il blu di bromotimolo, che vediamo in questa fotografia. A temperatura ambiente il blu di bromotimolo (3',3"-dibromotimolsolfonftaleina è il suo corretto nome scientifico) si presenta come un solido violetto, dall'odore di acido acetico; qui lo vediamo in soluzione acquosa. Aggiunto ad una soluzione, la colora di blu se è basica, di verde se è neutra, di giallo se è acida; per questo viene usato nella titolazione di soluzioni acide o basiche. Ha punto di viraggio a pH 7, cioè in questa condizione nessuno dei due colori caratteristici dell'indicatore è apprezzabile in modo evidente. |

|
Qui vediamo in azione il blu di bromotimolo, in un esperimento condotto con la collaborazione degli studenti della classe 1 G a.s. 2011/12. In un becker in cui è posto ghiaccio secco si versa acqua, in modo che esso sublimi. Se nel becker si aggiunge del blu di bromotimolo, esso assume un netto colore giallo, come mostra la foto a sinistra, perchè la CO2 reagisce con l'H2O, dando vita ad acido carbonico (H2CO3). Aggiungendo alcune gocce di idrossido di sodio (NaOH), il tutto diventa basico e la soluzione vira verso un deciso colore blu, come si vede a destra! |

|
Uno strumento ancora più perfezionato per eseguire misure di pH è rappresentato da questa scala cromatica prodotta per uso didattico da una nota industria chimica. Come si vede, ogni striscia di carta dispone di quattro tamponi imbevuti di diversi indicatori; basta immergere per qualche secondo la striscia nella soluzione da esaminare, e confrontare poi il colore di ogni quadratino con la scala colorata impressa sulla confezione. È un metodo empirico, ma sicuramente efficace per trovare il range di pH con una notevole precisione. |

|
Lo strumento in figura è detto apparecchio di Kipp dal nome del chimico olandese Petrus Kipp (1808 - 1864), e permette di ricavare in gran quantità i gas che si sviluppano sfruttando un'opportuna reazione chimica tra una soluzione acquosa acida e un solido insolubile; in pratica viene usato soprattutto per ottenere idrogeno o acido solfidrico. L'apparecchio di Kipp è formato da tre ampolle; la seconda e la terza dall'alto sono in comunicazione tra di loro, così come la prima e la terza. Se si vuole ottenere idrogeno gassoso, nella seconda vengono inseriti dei grani di zinco o ferro, mentre nella prima viene versata una soluzione di acido cloridrico al 20 % fino a che questo non sommerge completamente i grani solidi entro la seconda ampolla. Si sviluppa idrogeno in base alla reazione Zn + 2 HCl => ZnCl2 + H2. Quando il rubinetto collegato con la seconda ampolla è chiuso, la pressione dell'idrogeno che si sviluppa spinge la soluzione acida verso il basso fino a svuotare completamente la seconda ampolla, e ciò produce l'arresto della reazione chimica. Se invece o l'idrogeno prodotti viene estratto dall'apparecchio, la soluzione di acido cloridrico non scende, e la reazione continua senza sosta fino a che non si sarà consumato tutto il metallo. |

|
Le sostanze che, se disciolte in acqua o allo stato fuso, conducono la corrente elettrica vengono chiamate elettroliti. Prendiamo un solido tenuto assieme da legami di Van der Waals come una semplice zolletta di zucchero: gli elettroni sono tutti confinati all'interno della molecola di glucosio, non vi è possibilità che conducano corrente e quindi (vedi fotografia) la lampadina non si accende. |

|
Sciogliendo la zolletta di zucchero in acqua e ponendovi due elettrodi collegati alla solita lampadina, si vede che essa non si accende. Ne consegue che le molecole di glucosio non si ionizzano una volta disciolte in acqua, e dunque non possono condurre la corrente elettrica. Lo zucchero non è un elettrolita. |

|
Si noti che una sostanza può condurre corrente quando è in soluzione ma non allo stato solido. Prendiamo in considerazione del cloruro di sodio (sale da cucina, NaCl), versiamone un po' su un frammento di carta ed infiliamo in esso gli elettrodi. Si constata facilmente che il solido ionico non conduce corrente perchè gli ioni sono intrappolati nella struttura cristallina. |

|
Tuttavia, disciogliendo lo stesso sale in un becker di acqua, si verifica facilmente che esso conduce la corrente perchè la lampadina si è accesa. Infatti il cristallo di cloruro di sodio si dissolve in acqua e gli ioni liberi possono trasportare la corrente da un elettrodo all'altro. Il sale dunque è un elettrolita. |

|
In tema di conducibilità, questa è la semplicissima apparecchiatura da banco detta conducimetro a comparazione ottica per dimostrare intuitivamente la diversa conduzione delle varie soluzioni. Basta versare le soluzioni nei rispettivi bicchierini dotati di elettrodi, per vedere le lampadine accendersi con differente intensità a seconda della concentrazione di ioni nella soluzione. Se nei bicchierini verso per es. acido cloridrico ed acido acetico, quest' ultimo farà illuminare la lampadina assai meno del primo, visto che è molto meno forte dell'HCl. |

|
Dell'elettrochimica si parla anche nell'armadio virtuale di Elettromagnetismo, però in questo armadio non può mancare qualche utile esempio, come questa idrolisi o elettrolisi dell'acqua. Io sto indicando con il dito il polo negativo al quale avviene la formazione di idrogeno gassoso, che poi brucerà con fiamma azzurra restituendo acqua! Per saperne di più, cliccate qui. |
 |
Ed ecco un dispositivo più moderno per ottenere l'idrolisi, cioè l'elettrolisi dell'acqua, utilizzando degli elettrodi rovesciati sotto provette in una soluzione acidula. Se si accende un fiammifero e lo si infila nella provetta in cui si è formato idrogeno gassoso, si ode distintamente il fragore secco di una piccola esplosione, dovuta alla reazione tra l'idrogeno e l'ossigeno dell'aria a formare nuovamente acqua! |

|
Un altro esempio di una reazione favorita dal passaggio di corrente elettrica. In questo caso nel becker è stata posta una miscela elettrolitica di acqua e cloruro di sodio, il comune sale da cucina (NaCl); in esso poi sono stati immersi una lastrina di rame, collegata al polo positivo della pila, e un catodo che chiude il circuito (il cavo nero è collegato al polo negativo della pila). Dopo breve tempo, il becker appare invaso da una soluzione di colore verde. Come mai? |

|
La spiegazione è semplice. L'anodo di rame rilascia in soluzione ioni positivi Cu++, che reagiscono in soluzione con gli ioni cloruro Cl-, presenti nell'acqua perchè derivati dalla dissociazione del cloruro di sodio. e danno vita a cloruro rameico (CuCl2), un sale cristallino dal tipico colore verdazzurro. Come si vede, estraendo dalla soluzione la lamina di rame si nota che essa è stata erosa, a causa del rame passato in soluzione e combinatosi con gli ioni cloruro. |

|
Lasciando decantare la soluzione verdazzurra rimasta nel becker, è possibile raccogliere per filtrazione in un barattolo il cloruro rameico, che va trattato con attenzione e tenuto fuori dalla portata dei bambini perchè è molto tossico; lo si può conservare per ulteriori esperimenti, come i saggi alla fiamma (lo si usa ad esempio per colorare i fuochi artificiali) |

|
Questo pezzo da museo, particolarmente datato, è un esemplare di bagno galvanico, vale a dire un supporto di legno che regge degli elettrodi (in piombo, ferro, alluminio, zinco, carbone) da tuffare in una soluzione acida. Esso consente dimostrazioni della determinazione del coefficiente di resistività delle soluzioni, della costruzione del voltametro a rame, dell'accumulatore al piombo, del raddrizzatore elettrolitico nonché di esperienze di galvanostegia e galvanoplastica. |

|
La stufa termostatica è uno strumento in grado di riscaldare un qualunque preparato fino alla temperatura voluta e, una volta raggiuntala, di mantenerla costante fino a che non viene dato diverso input. Ciò avviene grazie ad un sistema di controreazione: una termocoppia misura la temperatura interna e, se essa oscilla rispetto alla temperatura prefissata più di un dato differenziale, la resistenza è comandata di conseguenza. Per esempio io fisso una temperatura di 250° ed un differenziale di 5°. Ciò significa che, se la temperatura scende sotto i 245°, si comanda l'accensione della stufa per riportarla al di sopra mentre, se sale sopra i 255°, la stufa si spegne in modo da farla rientrare nel corretto campo di oscillazione. |

|
Questa è una centrifuga, cioè una macchina nella quale si utilizza la forza centrifuga per separare un solido da un liquido, o due liquidi di differente densità. Il miscuglio viene posto dentro il rotore e posta in rapida rotazione intorno al proprio asse; l'accelerazione centrifuga fa sì che i componenti più pesanti tendano a disporsi verso l'esterno. Per la pubblicazione di questa ed altre immagini del laboratorio di scienze ringrazio il collega Carlo Puglisi. |

|
Il bagno chimico qui illustrato è un dispositivo usato nei laboratori chimici per riscaldare i recipienti in cui si devono effettuare le reazioni, quando si decide che una vasta superficie sia portata ad una temperatura elevata e piuttosto uniforme. Nei bagni chimici ad acqua (comunemente detti a bagnomaria) è il vapore d'acqua che, venendo a contatto uniformemente con la superficie, provvede al suo riscaldamento. |

|
Questo apparecchio davvero curioso è una colonna deionizzatrice (o colonna di scambio), spesso utilizzata nell'industria chimica, che realizza operazioni di scambio tra parti omogenee diverse di una miscela eterogenea. Al proposito è bene ricordare che si chiama deionizzazione l'operazione mediante la quale si rimuovono dalle soluzioni acquose i componenti ionici, cioè gli elettroliti. Essa viene effettuata mediante resine scambiatrici di ioni. La capacità di una resina di assorbire ioni da una soluzione è direttamente proporzionale alla loro carica e al loro peso atomico, perciò una resina cationica tende a scambiare più facilmente lo ione idrogeno H+, una anionica scambia più facilmente lo ione ossidrile OH-. |

|
Questo apparecchio si trova in dotazione ai termotecnici, perchè si tratta di un analizzatore usato per studiare la composizione chimica e i parametri fisici dei fumi emessi dalle caldaie. Il suo display digitale, come si vede, mostra la percentuale di ossigeno contenuta nel bruciatore (onde ottimizzare il fenomeno della combustione), la quantità di calore utilizzabile ed il rendimento della combustione stessa; è possibile visualizzare anche la percentuale di anidride carbonica e di ossido di carbonio. Ad esso è collegata un'apposita sonda che viene inserita direttamente nei tubi da analizzare. |

|
I vasi di terracotta fotografati qui a sinistra sono stati realizzati dagli alunni del mio Liceo, e ci permettono di illustrare questo materiale, ottenuto tramite cottura a 900-1000° C in un forno apposito di argilla cruda (creta), modellata e fatta essiccare per evitare che l'umidità in essa contenuta evaporando la faccia esplodere. La presenza di ossido di ferro le conferisce il colore tipico, variabile dal giallo al rosso mattone, e ne migliora la resistenza meccanica. È usata anche nei rivestimenti ad alta resistenza al calore, per le sue proprietà chimico-fisiche e il suo alto punto di fusione. |

|
Queste cassette da laboratorio illustrano i principali usi, nella tecnologia moderna, di alcuni importanti metalli; qui vediamo i principali usi industriali del ferro. Com'è noto, si tratta di un elemento chimico (metallo di transizione) che si trova in natura allo stato nativo solo in piccole quantità (in particolare nelle meteoriti), benché pare componga la stragrande maggioranza del nucleo terrestre, e va estratto dai suoi ossidi (ematite, magnetite, limonite) con il procedimento dell'altoforno. Da esso, a seconda del tenore di carbonio, si producono la ghisa e l'acciaio. Questo metallo è noto all'uomo almeno dal 1000 a.C., e lo sviluppo della sua industria ha praticamente coinciso con la prima Rivoluzione Industriale nel XVIII secolo. |

|
La cassetta a fianco illustra invece i principali usi industriali dell'alluminio, metallo del 3° periodo (i cosiddetti "metalli terrosi"), che dopo l'ossigeno e il silicio è il terzo elemento più abbondante nella crosta terrestre (circa l'8 %). Non si trova mai allo stato nativo; come ossido è presente nel corindone, come ossido idrato nella bauxite (Na3AlF6), dalla quale si estrae industrialmente con il metodo Bayer. È un metallo bianco-argenteo scoperto nel 1827, molto più leggere del ferro ed assai resistente alla corrosione; lo si utilizza in elettrotecnica, nell'industria dei trasporti e negli imballaggi ("carta d'alluminio"). |

|
Passiamo allo zinco, elemento di transizione del 4° periodo; utilizzato fin dal 1000 a.C. per produrre l'ottone, ma descritto come metallo a sé stante solo nel 1520. In natura non è abbondante; il suo minerale più abbondanti è la blenda (ZnS), spesso associata a minerali di piombo e ferro. Si tratta di un metallo bianco-argenteo, facilmente lavorabile già a 150°; se esposto all'aria forma una patina protettiva di ossido. L'applicazione tecnologica più importante dello zinco è quella come rivestimento protettivo delle leghe di ferro (zincatura); la sua lega con alluminio e rame, detta Zama, è usata negli elettrodomestici. |

|
Altro metallo importantissimo nell'industria moderna è il piombo, metallo appartenente al 6° periodo, nel quale hanno termine quasi tutte le catene di decadimento radioattivo a noi note. Forse per la relativa facilità con cui può essere estratto dai suoi minerali (galena, cerussite), fu uno dei primi metalli ad essere scoperto dall'uomo, forse verso il 5000 a.C. I Romani lo adoperavano su larga scala per le tubature dei loro acquedotti; gli alchimisti del Medioevo lo associarono al pianeta Saturno, da cui il nome di "saturnismo" dato all'intossicazione da piombo. Oggi è utilizzato negli accumulatori elettrici. |

|
Mancando una cassetta come le precedenti, a rappresentare l'industria del rame ho posto queste due pentole fabbricate proprio con questo metallo, appartenente al quarto periodo. In natura può trovarsi allo stato nativo oppure sotto forma di ossidi (es. cuprite) o solfuri (es. calcopirite). Si hanno testimonianze di uso del rame in Mesopotamia fin da prima il 5000 a.C.; la sua scoperta concluse l'età della pietra ed iniziò quella dei metalli. È usatissimo in elettrotecnica per la sua elevata conducibilità. |

|
L'argento è un metallo appartenente al 5° periodo e alla II serie di transizione. Il suo nome deriva da una radice indoeuropea che significa "lucente"; è estremamente duttile e malleabile, e non viene attaccato dall'ossigeno; per questo viene utilizzato per realizzare posate e soprammobili. Il suo imbrunimento con il tempo è dovuto alla formazione di solfuro nero (AgS). È inoltre il miglior conduttore elettrico e termico che si conosca. In natura è molto raro; in piccole quantità lo si trova allo stato nativo. |

|
Questa fotografia, ripresa durante la mia visita alla mostra "L'esplorazione del Sistema Solare" organizzata a Tradate (VA) dal GAT, mostra una boccetta contenente alcune foglie d'oro raccolte nel fiume Ticino, di proprietà di Giuseppe Macalli, ed un paio di piccole pepite dell'Arizona. L'oro è un metallo appartenente al 6° periodo e alla III serie di transizione, e secondo alcuni fu addirittura il primo metallo scoperto dall'uomo, già nel Paleolitico, perchè in natura lo si trova in natura per l'appunto sotto forma di fogliette sottili, talora fuse insieme in "pepite". Spesso è associato a pirite e ad argento. Nel passato si scatenarono vere e proprie "corse all'oro", come quella che portò al popolamento del Far West a partire dal 1848. |

|
Qui vedete ritratta una fiala contenente gallio, un metallo dal tipico colore argenteo che liquefa a soli 30°C; infatti, come si vede dalla fotografia, basta tenerlo tra le dita perchè passi allo stato liquido. Scoperto nel 1875 dal chimico francese Paul Émile Lecoq de Boisbaudran (1838-1912), per le sue proprietà è oggi impiegato nei termometri per alte temperature, cristalli liquidi e LED; assorbendo i neutrini solari, si trasforma in germanio, per cui è utilizzato nelle ricerche astrofisiche. La fiala in figura è di proprietà del mio allievo Andrea Cristante (2 D a.s.2016/17). |

|
Una bella collezione di "metalli speciali", come recita la didascalia: da sinistra, zirconio, antimonio, sodio, calcio, silicio e boro, tutti da usarsi per esperienze di chimica. Il sodio è immerso nel petrolio perché a contatto con l'umidità dell'aria brucia, essendo un forte riducente: ciò che si riduce è l'H+, che passa ad H2 gassoso; questo per la violenta reazione si incendia! |

|
Questo, che vedete da me fotografato al CERN di Ginevra, è un contenitore di elio liquido. L'elio è il secondo elemento della tavola periodica, è un gas nobile (non fa legami chimici con altre sostanze) e possiede il più basso punto di ebollizione tra tutti gli elementi: 4,24 K (−268,93 °C). Inoltre è l'unica sostanza che non può essere solidificata abbassandone solo la temperatura; in altre parole, rimane liquido fino allo zero assoluto a pressione standard (si può solidificare solo aumentando la pressione). È usato per rendere superconduttori i metalli, in questo caso i grandi magneti del CERN! |

|
Persino dei comuni fiammiferi possono insegnare molto di chimica; infatti sono a base di fosforo, non metallo appartenente al quinto gruppo del sistema periodico. Si presenta in varie forme allotropiche, tra cui il fosforo bianco, un veleno molto potente che si autoincendia nell'aria, ed il fosforo rosso, stabile, insolubile e non tossico, usato appunto nei fiammiferi. I cosiddetti "fiammiferi di sicurezza", ideati nel 1844 da Gustaf Erik Pasch, hanno la capocchia di solfato di antimonio e clorato di potassio, che si incendia solo se sfregata su di una superficie appositamente preparata, fatta di vetro in polvere e fosforo rosso. L'attrito dello sfregamento trasforma il fosforo rosso in bianco, e questo si infiamma, accendendo così la capocchia del fiammifero |

|
La scatola in figura illustra svariate leghe metalliche. Si tratta di materiali composti da due o più elementi chimici, generalmente metallici; in pratica sono delle soluzioni allo stato solido. Hanno caratteristiche tipiche dei metalli, e particolari qualità che le rendono utili alla tecnologia. La prima lega della storia fu il bronzo, ottenuto verso il 2500 a.C. dalla fusione di rame e stagno; legando rame e zinco si ha invece l'ottone. La ghisa e l'acciaio sono invece leghe ferro-carbonio con diverse percentuali di C. |

|
Il tabellone che vediamo in figura sintetizza invece l'industria della carta. Questo materiale, così indispensabile per la nostra vita quotidiana, fu inventato dai Cinesi nel II sec. d.C., ed introdotto in Europa dopo il 1000 per opera degli Arabi. Nel 1798 fu inventata la macchina continua per la fabbricazione della carta. Si tratta in pratica di una pasta cellulosica tirata in fogli sottili e fatta asciugare; un tempo venivano utilizzati stracci di lino e cotone, mentre oggi questi materiali sono sfruttati solo per produrre i tipi più fini di carta; la produzione industriale avviene a partire da pasta di legno. |

|
Altro tabellone da laboratorio con le principali fibre tessili artificiali, a partire dalla seta sintetica. Si tratta di materiali caratterizzati da una direzione longitudinale prevalente su quella trasversale, e da elasticità, resistenza e finezza tali da renderli adatti alla filatura. In generale sono ricavate da polimeri sintetici (poliammidi, poliesteri, poliuretani...) Le fibre poliammidiche sono conosciute con il nome commerciale di nylon, adatte anche per produrre pellicole da imballaggio. |

|
E qui siamo ai concimi chimici, sostanze che si aggiungono al terreno per fertilizzarlo, cioè per arricchirlo degli elementi nutritivi necessari ai vegetali. I concimi ricchi di azoto stimolano l'attività vegetativa e ritardano la maturazione della frutta; quelli ricchi di fosforo al contrario stimolano la maturazione; quelli ricchi di calcio neutralizzano l'acidità del succhi cellulari. I concimi agiscono spesso sul terreno anche come correttivi, modificandone le proprietà fisiche e chimiche secondo le esigenze degli agricoltori. |

|
Chiudiamo questo Armadio Virtuale con una cassetta che sintetizza la lavorazione del cotone. Si tratta di un tipico esempio di fibra tessile naturale. Queste ultime sono suddivise in fibre cellulosiche o vegetali, come il lino e appunto il cotone, e fibre proteiche o animali, come la lana e la seta. Il cotone in particolare è ricavato dalla peluria che circonda i semi della pianta di Gossypium (famiglia delle malvacee). E con questo abbandoniamo la chimica e ci inoltriamo nel mondo della Botanica. |
| Le esperienze di chimica fotografate si devono alla cortesia della collega Raffaella Calbucci | |
| Queste immagini possono essere liberamente utilizzate da chiunque, purché se ne citi la fonte | |
 |
 |
 |
 |
 |
 |