![]()
|
"Percuote il sole ardente il vicin colle; L.Ariosto, "Orlando Furioso", VIII, 153-156 |
.
Dedicato al mio studente Niki Braho
.
0.1 Premessa
Si sa che lo studio dell'evoluzione di un sistema composto da una o più particelle materiali può essere condotto per mezzo delle equazioni della meccanica. Quando però le particelle diventano numerosissime, questo studio non può più essere condotto nel dettaglio per mezzo di quel sistema, per via dei complicatissimi calcoli necessari per trattare un sistema fatto di miliardi di quei corpuscoli. Eppure, praticamente ogni corpo che cade sotto i nostri occhi si trova in queste condizioni. Un solo grammo di acqua allo stato liquido contiene infatti la bellezza di N = 3 x 1022 molecole, un numero talmente grande che è pari alle cucchiaiate necessarie per svuotare tutti gli oceani della Terra! Sia pure trascurando la forma e i moti interni delle molecole, vale a dire trattandole come se fossero a tutti gli effetti dei corpi puntiformi, privi di struttura interna, un tale studio richiederebbe la soluzione di 3 N = 9 x 1022 equazioni, che peraltro non sarebbero semplici equazioni algebriche ma ostiche equazioni differenziali (il Secondo Principio della Dinamica di Isaac Newton è infatti un'equazione differenziale), e quindi la conoscenza di 6 N = 2 x 1023 condizioni iniziali (le tre componenti della posizione e le tre componenti della velocità all'istante t = 0). È impossibile pensare di poter affrontare una simile mole di calcoli, sia pure con l'aiuto dei più potenti calcolatori elettronici a disposizione nei nostri anni Duemila, giacché la vita stessa dell'universo sarebbe troppo corta per poterli svolgere tutti in modo preciso!
Peraltro, come se ciò non bastasse, la conoscenza delle condizioni cinematiche (posizione e velocità) di ciascuna particella che compone un corpo macroscopico è, in genere, priva di interesse pratico, poiché non ci servirebbe a nulla conoscere una lista di 3 x 1022 posizioni e di 3 x 1022 velocità, ciascuna completa delle sue tre componenti lungo x, y e z. A noi interessa piuttosto l'evoluzione macroscopica di quel sistema, giacché solitamente noi siamo interessati solo ad effetti sensibili su scala umana. Lo stato del sistema dovrà quindi essere caratterizzato mediante osservazioni di tipo globale, che "riassumano" in qualche modo ciò che accade a livello microscopico. Questo è il principale scopo della branca della Fisica nota con il nome di TERMODINAMICA.
Il metodo con cui essa opera consiste dunque nel definire in modo operativo (cioè spiegando come calcolare le quantità sotto esame) un certo numero di osservabili fisiche, dette variabili termodinamiche, e nel trovare le equazioni che le legano, sia che si tratti di leggi di portata generale, sia che si tratti di relazioni valide in casi particolari. Per determinare le variabili termodinamiche e le leggi che le regolano, si opera sempre a livello macroscopico, senza necessariamente tenere conto della struttura interna microscopica dei corpi estesi, e quindi ignorando volutamente lo stragrande numero di atomi e di molecole che li compongono. Tuttavia, ogni variabile termodinamica è pur sempre legata allo stato o all'evoluzione della moltitudine di particelle microscopiche. Solitamente, il passaggio dalle variabili microscopiche meccaniche a quelle macroscopiche termodinamiche si effettua mediante un'operazione di somma e di media; ad esempio, l'energia interna sarà pari alla somma delle energie meccaniche di tutte le particelle del sistema.
.
0.2 Nota storica
La termodinamica è una scienza nata dall'esperienza, e si è evoluta nel corso dei secoli grazie alle continue osservazioni e sperimentazioni; raramente le sue conquiste sono state il frutto di dimostrazioni teoriche precedenti l'esperienza, e la stessa macchina a vapore è frutto dell'abilità ingegneristica di alcuni geni, e non di calcoli teorici. Normalmente si fa risalire l'inizio di questa scienza al matematico greco Erone di Alessandria, del quale si sa solo che visse nel primo secolo dopo Cristo; sua infatti è l'invenzione dell'eolipila ("sfera di Eolo"), ritenuta la prima macchina a vapore della storia e descritta nell'opera "Pneumatica". Grazie ad essa l'energia termica viene convertita in energia meccanica sfruttando la pressione derivante dal riscaldamento di acqua all'interno di una sfera metallica: il vapore esce da due ugelli orientati in direzioni opposte, facendo ruotare velocemente la sfera. Nella stessa opera, Erone dimostra come sia possibile aprire le porte di un tempio sfruttando il vapore dell'acqua calda. L'abbondanza di manodopera derivante dagli schiavi di guerra o per debiti, unitamente all'assenza di una vera industria in senso moderno, impedirono però la prosecuzione di tali studi, sicché i lavori avveniristici di Erone restarono al livello di meri giocattoli.
Dopo i tentativi di usare il vapore da parte del solito Leonardo da Vinci (1452-1519), con la sua macchina detta "archituono", e di Giovanni Battista Della Porta (1535-1615), i primi studi moderni sul calore furono condotti da Galileo Galilei (1564-1642), il quale costruì un rudimentale termometro basato sulla variazione della densità dei corpi. Invece i primi studi sulle proprietà dei gas risalgono al XVII secolo, per opera dell'inglese Robert Boyle (1627-1691) e dei francesi Edme Mariotte (1620-1668) e Denis Papin (1647-1712). Quest'ultimo inventò in particolare il cosiddetto "digestore" o "pentola di Papin" che dà il nome a questo ipertesto: un recipiente in pressione nel quale l'acqua bolle a temperatura maggiore di 100°C, permettendo di cuocere il cibo più a lungo e di renderlo più digeribile (da cui il nome di "digestore"). La pentola di Papin è l'antenata della moderna pentola a pressione, che cominciò a diffondersi nel 1927, prodotta dalla ditta tedesca Silit.

Denis Papin, uno dei precursori della Termodinamica
A quell'epoca il calore non era considerato una forma di energia, ma di materia: precisamente, un fluido imponderabile che permea tutti i corpi e può passare da uno all'altro, chiamato fluido calorico. Questa teoria fu sostenuta tra gli altri da Henry Cavendish (1731-1810), Antoine-Laurent de Lavoisier (1743-1794) e Alessandro Volta (1745-1827)Se infatti si pongono a contatto un corpo più caldo ed uno più freddo, il calore fluisce dal più caldo al più freddo, cosicché il primo si raffredda e il secondo si riscalda, in modo che entrambi raggiungono la stessa temperatura: esattamente come, per il principio dei vasi comunicanti, l'acqua fluisce dal recipiente a livello maggiore a quello a livello minore, finché entrambi non raggiungono lo stesso livello. Tra XVIII e XIX secolo però le cose cominciarono a cambiare. Nel 1738 Leonardo Eulero (1707-1783) affermò per primo che « il calore consiste in un certo moto delle particelle dei corpi ». Nello stesso anno Daniel Bernoulli (1700-1782) riuscì a determinare la pressione di un gas sulle pareti di un recipiente attribuendo al calore la causa della velocità delle particelle che lo costituiscono. Intanto, procedevano gli studi su base empirica per la realizzazione della macchina a vapore. Thomas Savery (1650-1715) nel 1698 depositò il brevetto di una pompa per l'aspirazione dell'acqua dalle miniere di carbone, che operava con il vapore grazie a un contenitore a due valvole, ispirato alla pentola di Papin (ed è per questo che io ho deciso di intitolare a Papin questo ipertesto di argomento termodinamico); Thomas Newcomen (1664-1729) nel 1705 perfezionò l'idea del suo socio Savery, realizzando una macchina sfruttabile commercialmente che diede ufficialmente l'avvio alla Rivoluzione Industriale; e James Watt (1736-1819) nel 1765 completò l'opera, introducendo il regolatore centrifugo o regolatore di Watt per mantenere costante la velocità della macchina a vapore, aumentandone di molto l'efficienza e trovando il modo di trasformare il moto rettilineo alternato dello stantuffo nel moto rotatorio continuo di un albero mediante il rivoluzionario sistema biella-manovella.
Riguardo invece gli sviluppi teorici, fu proprio cercando di risolvere il problema della conduzione del calore attraverso un corpo solido che il francese Jean Baptiste Joseph Fourier (1768-1830) diede l'avvio alla Fisica Matematica, scrivendo e risolvendo in alcuni casi particolari la famosa Equazione di Fourier, secondo la quale il flusso di calore attraverso un superficie in un certo tempo avviene in virtù di un gradiente di temperatura. Nei primi anni dell'ottocento il tedesco Julius Robert von Mayer (1814-1878) e gli inglesi Benjamin Thompson (1753-1814) e James Prescott Joule (1818-1889) posero le basi della termodinamica come noi la conosciamo, stabilendo l'equivalenza tra calore e lavoro e superando definitivamente la teoria del calorico; essi formularono inoltre il Primo Principio della Termodinamica. Nel 1824 Nicolas Léonard Sadi Carnot (1796-1832) elaborò la prima formulazione del Secondo Principio, favorito dal fatto che suo padre Lazare, fisico pure lui, studiava l'efficienza delle macchine termiche. A lui si deve tra l'altro il concetto di "macchina di Carnot". Il Secondo Principio fu poi diversamente riformulato dall'inglese William Thomson, meglio noto come Lord Kelvin (1824-1907), il quale introdusse il concetto di zero assoluto e di cala assoluta delle temperature, e dal tedesco Rudolf Clausius (1822-1888), con il quale l'irreversibilità e il concetto di "freccia del tempo" fecero il loro ingresso nel mondo della fisica. Poi James Clerk Maxwell (1831-1879), Josiah Willard Gibbs (1839-1903) e Ludwig Boltzmann (1844-1906) svilupparono la meccanica statistica, un modo originale di approccio alla termodinamica, che tratta i gas come popolazioni molto numerose di particelle a cui applicare i principi della statistica. Infine, l'olandese Johannes Diderik van der Waals (1837-1923) tentò di applicare i principi della termodinamica, validi per i gas ideali, anche ai gas reali, e per questo ottenne nel 1910 il Premio Nobel per la Fisica.
.
0.3 Sistema termodinamico
Prima di iniziare lo studio della termodinamica, è bene avere chiari alcuni concetti fondamentali.
Def. 0.1: Dicesi sistema termodinamico una qualunque porzione di materia di estensione tale da contenere un numero così grande di particelle che si possa ritenere realizzata, con approssimazione sufficiente al fine dei calcoli che si intendono svolgere, ogni condizione subordinata al tendere all'infinito del numero di particelle. In pratica, qualunque oggetto abbastanza grande da poter essere "sensibile" per un essere umano è da considerarsi un sistema termodinamico.
Def. 0.2: Dicesi frontiera del sistema una superficie contenente tutte le particelle del sistema, e nessuna ad esso estranea.
A livello microscopico, la definizione di "frontiera" non è affatto agevole, ed è talvolta addirittura impossibile, poiché al contatto tra corpi diversi si crea non una superficie nel senso classico della parola, bensì uno strato di transizione, in cui sostanze diverse si combinano e si compenetrano. Tuttavia, nello spirito della termodinamica, l'individuazione della frontiera è da intendersi anch'essa a livello macroscopico, per cui lo spessore dello stato di transizione, che è in genere dell'ordine delle dimensioni molecolari, è da ritenersi del tutto trascurabile.
Def. 0.3: Dicesi ambiente tutto ciò che non fa parte del sistema; poiché però le interazioni tra sistema ed ambiente avvengono soprattutto con gli oggetti più prossimi, ai fini dello studio di queste interazioni la conoscenza dell'ambiente può essere limitata solo alle porzioni di materia circostante.
Le condizioni di un sistema vengono individuate da un certo numero di grandezze o parametri, esattamente come le dimensioni del seno, della vita e dei fianchi caratterizzano il corpo di una donna.
Def. 0.4: tali grandezze si dicono variabili di stato. Esse caratterizzano quello che si chiama semplicemente lo stato del sistema.
L'acqua che si trova sul fornello acceso per preparare la pastasciutta, per esempio, si trova in uno stato ben definito: il numero e la natura delle variabili di stato dipendono dal tipo di scambio e di trasformazioni che si realizzano in un sistema.
Ora però, poiché la termodinamica si interessa soprattutto di scambi energetici, non si prendono di solito in considerazioni come variabili termodinamiche quelle caratteristiche (anche macroscopiche) dei sistemi che possono variare senza assorbimento né cessione di energia. Ad esempio, l'estensione della superficie di un corpo è una variabile da prendere in considerazione solo se la sua variazione comporta effetti energetici sul sistema.
Def. 0.4.1: una grandezza di stato si dice estensiva quando il suo valore per un sistema Σ costituito dall'unione di due sottosistemi Σ1 e Σ2, è pari alla somma dei due valori per Σ1 e Σ2. Sono estensive ad esempio la massa ed il volume.
Def. 0.4.2: una grandezza di stato si dice intensiva se, nel caso del sistema suddetto, ha lo stesso valore tanto per Σ quanto per Σ1 e per Σ2. Sono intensive ad esempio la temperatura e la pressione.
In altre parole, una grandezza estensiva dipende dalla quantità di materia contenuta nel sistema, mentre una grandezza intensiva è indipendente da essa.
Si può verificare che l'entità di ogni scambio energetico può essere espressa come il prodotto di due variabili di stato, una intensiva ed una estensiva. Questo consente di affermare che esiste una "corrispondenza" tra ogni variabile estensiva ed una corrispondente variabile intensiva. Vedremo per esempio che il lavoro compiuto da un sistema in espansione si può esprimere come il prodotto tra la sua pressione e la variazione di volume, ed il calore che esso scambia si esprime come il prodotto della sua temperatura per la sua variazione di entropia. E chi negherebbe che lavoro e calore sono forme di energia?
Una volta definito un gruppo di variabili di stato indipendenti tra di loro, è possibile definire mediante operazioni matematiche un numero arbitrario di nuove variabili, che possono essere sostituite alle precedenti per descrivere le condizioni del sistema. L'introduzione di nuove variabili sarà sensata solo se le nuove variabili si presteranno a descrizioni particolarmente sintetiche, e se interverranno direttamente nelle leggi da determinare. Per esempio, se V è il volume del sistema, V3 non è una variabile di stato significativa, ma lo è ( U + P V ), che rappresenta l'entalpia del sistema. Inoltre, la natura del sistema impone che esso possa sussistere in condizioni stazionarie solo se le variabili di stato soddisfano ad alcuni vincoli. Queste relazioni (dette leggi di stato) fanno sì che, all'equilibrio, il numero delle variabili indipendenti si riduca. Per esempio, è evidente che la forza a cui un corpo è sottoposto, la sua massa e la sua accelerazione non siano indipendenti tra loro, in una situazione di equilibrio meccanico, perchè risultano legate dal Secondo Principio della Dinamica:
![]()
In generale, si può pensare che il numero di variabili indipendenti del sistema è pari al numero degli scambi energetici possibili. Ora, nella nostra trattazione consideriamo scambi di energia solo in forma meccanica (lavoro) o termica (calore), trascurando reazioni chimiche e/o nucleari, per cui in generale avremo due variabili indipendenti, dettate di volta in volta da semplici ragioni di convenienza.
Tutte le variabili del sistema sono, in linea di principio, determinabili in funzione di queste grandezze di stato. Ciò si esprime dicendo che queste variabili dipendenti sono delle grandezze di stato o funzioni di stato, cioè i loro valori dipendono solo dallo stato del sistema al momento attuale, e non dal modo in cui si è pervenuti ad esso, non cioè dalla storia pregressa del sistema, ovvero dalla sua evoluzione. Altre variabili invece possono essere conosciute solo studiando tutta l'evoluzione del sistema, e non possono essere definite funzioni di stato.
Quanto segue è comprensibile solo da chi conosca i fondamenti dell'Analisi Matematica, per cui gli studenti liceali possono trascurare questo capoverso; ogni volta che tratteremo di argomenti riguardanti l'Analisi Matematica, lo segnalerò con questo colore, in modo che gli studenti delle scuole superiori possano passare oltre. Ebbene, si dice che le funzioni di stato sono esprimibili sotto forma di differenziali esatti, mentre le altre sotto formule di differenziali non esatti. Si dice che il differenziale dU è esatto se può essere scritto nella forma:
dU = A1 ( x1; x2; ...; xn ) dx1 + A2 ( x1; x2; ...; xn ) dx2 + ... + An ( x1; x2; ...; xn ) dxn
e se esiste una funzione U ( x1; x2; ...; xn ), detta potenziale, tale che:
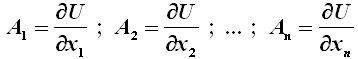
dove quelle indicate sono derivate parziali. In due variabili, come nei casi che affronteremo noi, il differenziale dU = A ( x; y ) dx + B ( x; y ) dy è esatto se:
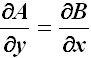
Infatti, per definizione di potenziale, la precedente si può scrivere:
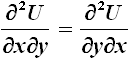
che esprime il cosiddetto Lemma di Schwarz: le derivate parziali seconde di una funzione di più variabili sono uguali tra di loro.
Ad esempio, si consideri il differenziale dU = 2 x y3 dx + 3 x2 y2 dy. Esso è esatto, perchè:
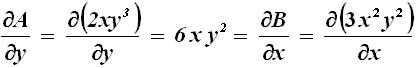
Si può verificare facilmente che in questo caso U ( x; y ) = x2 y3. Invece il differenziale y2 dx + x2 dy manifestamente non è esatto, perché:
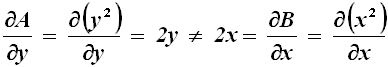
Noi indicheremo il differenziale non esatto con la scrittura d*U. Vedremo nel § 1.5 che il calore e il lavoro non sono grandezze di stato, e quindi li indicheremo rispettivamente con le scritture d*Q e d*W.
I vincoli cui obbediscono le grandezze di stato prendono il nome di equazioni di stato, mentre il loro andamento disegnato in opportuni piani, che studieremo insieme, detti piani termodinamici, prendono il nome di diagrammi termodinamici; vedremo insieme in quali condizioni sarà possibile disegnarli. Detto questo, possiamo inoltrarci insieme nello studio di questa grande branca della Fisica.

Anche Paperino è alle prese con le molecole sulla
copertina di "Topolino"
n°2916 del 12 ottobre 2011!
.
Nel primo capitolo cominceremo con l'introdurre i concetti basilari di calore e temperatura; la spiegazione delle transizioni di fase sarà oggetto del secondo capitolo, mentre dedicheremo il terzo allo studio dello stato gassoso e il quarto alla trattazione dettagliata del Primo Principio della Termodinamica, una nuova formulazione della conservazione dell'energia. Il quinto capitolo sarà occupato dall'esposizione del Secondo Principio della Termodinamica, premessa naturale al concetto di irreversibilità. Con il sesto capitolo passeremo al fondamentale concetto di entropia, mentre nel settimo parleremo dell'intima (e insospettabile) relazione tra entropia e probabilità. L'ottavo capitolo sarà assai complesso, sintetizzando la teoria cinetica dei gas attraverso tutta la sua difficile formulazione matematica, mentre nel nono ed ultimo esporremo l'approccio cinetico alla termodinamica. Infine, nell'Appendice approfondiremo una diversa trattazione matematica di alcune delle principali grandezze termodinamiche. L'ipertesto verrà concluso dagli esercizi, con relative soluzioni, mediante i quali potrete mettere alla prova le conoscenze da voi acquisite consultando il mio lavoro. Infine, se volete scrivermi il vostro parere su questo mio ipertesto, scrivetemi cliccando sull'icona sottostante. Per iniziare con me l'affascinante viaggio attraverso i segreti della termodinamica, cliccate qui. Buon viaggio!
![]()
Indice ipertestuale
CAPITOLO
1: CALORE E TEMPERATURA
§ 1.1 Le variabili termodinamiche
§ 1.2 L'equilibrio termodinamico
§ 1.3 Il Principio Zero della
Termodinamica
§ 1.4 Scale termometriche e la
dilatazione termica
§ 1.5 La quantità di calore
§ 1.6 I calori specifici
CAPITOLO
2: LE TRANSIZIONI DI FASE
§ 2.1 I passaggi di stato
§ 2.2 I calori latenti
§ 2.3 Il diagramma delle fasi
§ 2.4 La regola delle fasi
CAPITOLO
3: LO STATO GASSOSO
§ 3.1 Le leggi dei gas ideali
§ 3.2 Lo zero assoluto
§ 3.3 L'equazione di stato dei gas
ideali
§ 3.4 Isoterme dei gas reali
§ 3.5 L'equazione di van der Waals
CAPITOLO
4: IL PRIMO PRINCIPIO DELLA TERMODINAMICA
§ 4.1 Il lavoro esterno
§ 4.2 Il lavoro lungo alcune particolari
trasformazioni
§ 4.3 Il Primo Principio della Termodinamica
§ 4.4 Il moto perpetuo di prima spacie
§ 4.5 Interpretazione cinetica del Primo Principio
§ 4.6 Determinazione dell'energia interna
§ 4.7
La Relazione di Mayer e la trasformazione adiabatica
§ 4.8 Il calore specifico delle politropiche
§ 4.9 L'entalpia e la Legge di Hess
CAPITOLO
5: IL SECONDO PRINCIPIO DELLA TERMODINAMICA
§ 5.1 Il concetto di irreversibilità
§ 5.2 L'enunciato di Kelvin
§ 5.3 Il Ciclo di Carnot
§ 5.4 L'enunciato di Clausius
§ 5.5 La macchina frigorifera
§ 5.6 Il Terzo Principio della
Termodinamica
CAPITOLO
6: IL CONCETTO DI ENTROPIA
§ 6.1 La degradazione dell'energia
§ 6.2 L'integrale di Clausius
§ 6.3 L'entropia del gas perfetto
§ 6.4 Il piano di Gibbs
§ 6.5 Le politropiche nel piano di Gibbs
§ 6.6 L'energia libera di Gibbs
§ 6.7 L'Equazione di Clapeyron e la tensione di vapore
§ 6.8 Il Ciclo Rankine
§ 6.9 Ciclo Otto e Ciclo Diesel
CAPITOLO
7: ENTROPIA E PROBABILITÀ
§ 7.1 Verso la morte termica
§ 7.2 Enunciato probabilistico del
Secondo Principio
§ 7.3 Probabilità termodinamica
§ 7.4 L'equazione di Boltzmann
§ 7.5 Entropia e probabilità
termodinamica
§ 7.6 Entropia e disordine
§ 7.7 Estensione del concetto di entropia
CAPITOLO
8: LA TEORIA CINETICA DEI GAS
§ 8.1 Variabili discrete e cntinue
§ 8.2 La distribuzione gaussiana
§ 8.3 Dal moto browniano alla fisica
statistica
§ 8.4 Approccio cinetico alla
termodinamica
§ 8.5 La temperatura dal punto di
vista cinetico
§ 8.6 La propagazione sonora nei gas
CAPITOLO
9: LA DISTRIBUZIONE DI MAXWELL
§ 9.1 Nello spazio delle velocità
§ 9.2 La forma della maxwelliana
§ 9.3 L'esperienza di Stern
§ 9.4 Il teorema di equipartizione
dell'energia
§ 9.5 Validità del modello cinetico
§ 9.6
La distribuzione di Bose-Einstein
§ 9.7
La distribuzione di Fermi-Dirac
APPENDICE: LA PROPAGAZIONE DEL CALORE
§ A.1 Fourier e la conduzione del
calore
§ A.2 L'equazione di Fourier
§ A.3 La convezione del calore
§ A.4 L'irraggiamento
.


Qui sopra: due scene del 26° episodio della quinta stagione di "Star Trek, The Next Generation" intitolata "Time's Arrow" ("Un mistero dal passato"). All'inizio dell'episodio il capitano Jean-Luc Picard (interpretato da Patrick Stewart) e l'androide Data (interpretato da Brent Spiner) scoprono in un sito archeologico del pianeta Terra la... testa di Data stesso! Viene fuori che degli alieni hanno viaggiato nel tempo fino al XIX secolo, in senso contrario rispetto a quella che la Termodinamica chiama la "freccia del tempo". Nel fotogramma in basso si vede l'aliena Guinan (interpretata da Whoopi Golberg), che diverrà la barista dell'Enterprise-D, in compagnia del famoso scrittore americano Samuel Langhorne Clemens (1835-1910), meglio noto con lo pseudonimo di Mark Twain (interpretato da Jerry Hardin). Della "freccia del tempo" parleremo diffusamente nel capitolo 7.
![]()